Suvning tuzilishi. Suvning xususiyatlari Muz va suvning molekulyar darajadagi asosiy farqlari
Tabiatdagi qattiq suvning hozirgi vaqtda ma'lum bo'lgan 14 ta shaklidan biz faqat bittasini topamiz - muz. Qolganlari ekstremal sharoitlarda shakllangan va maxsus laboratoriyalardan tashqari kuzatuvlar uchun mavjud emas. Muzning eng qiziqarli xususiyati uning tashqi ko'rinishlarining ajoyib xilma-xilligidir. Xuddi shu kristalli tuzilishga ega bo'lib, u shaffof do'l va muz toshlari, bekamu qor parchalari, qor maydonidagi zich porloq qobiq yoki ulkan muzlik massalari shaklida butunlay boshqacha ko'rinishi mumkin.
Xonsyu orolining g'arbiy qirg'og'ida joylashgan Yaponiyaning kichik Kaga shahrida g'ayrioddiy muzey mavjud. Qor va muz. U laboratoriyada sun'iy qor parchalarini o'stirishni birinchi bo'lib osmondan tushayotgandek go'zal o'stirishni o'rgangan Ukixiro Nakaya tomonidan asos solingan. Ushbu muzeyda tashrif buyuruvchilar har tomondan muntazam oltiburchaklar bilan o'ralgan, chunki oddiy muz kristallariga xos bo'lgan aynan mana shu "olti burchakli" simmetriya (Aytgancha, yunoncha kristallos so'zi aslida "muz" degan ma'noni anglatadi). U o'zining ko'plab noyob xususiyatlarini aniqlaydi va qor parchalarini cheksiz xilma-xilligi bilan oltita, kamroq uch yoki o'n ikki nurli yulduzlar shaklida o'stiradi, lekin hech qachon to'rt yoki beshta nur bilan o'smaydi.
Ochiq ishdagi molekulalar
Qattiq suv tuzilishining kaliti uning molekulasining tuzilishida yotadi. H2O sodda tarzda tetraedr (uchburchak asosli piramida) sifatida ifodalanishi mumkin. Markazda kislorod, ikkita tepada vodorod, aniqrog'i proton joylashgan bo'lib, uning elektronlari kislorod bilan kovalent bog'lanish hosil bo'lishida ishtirok etadi. Qolgan ikkita cho'qqi kislorodning valentlik elektronlari juftligi bilan band bo'lib, ular molekula ichidagi bog'lanishlar hosil bo'lishida ishtirok etmaydi, shuning uchun ular yolg'iz deb ataladi.
Bir molekula protoni boshqa molekulaning bir juft yolg'iz kislorod elektronlari bilan o'zaro ta'sirlashganda, vodorod bog'i hosil bo'ladi, bu molekula ichidagi bog'lanishdan kamroq kuchli, lekin qo'shni molekulalarni ushlab turish uchun etarlicha kuchli. Har bir molekula bir vaqtning o'zida boshqa molekulalar bilan qat'iy belgilangan burchaklarda to'rtta vodorod aloqasini hosil qilishi mumkin, bu esa muzlatilgan holda zich tuzilmani yaratishga imkon bermaydi. Vodorod aloqalarining bu ko'rinmas doirasi molekulalarni ichi bo'sh kanallari bo'lgan dantelli tarmoqqa joylashtiradi. Muz qizdirilishi bilan dantel qulab tushadi: suv molekulalari to'rning bo'shliqlariga tusha boshlaydi, bu suyuqlikning yanada zich tuzilishiga olib keladi, shuning uchun suv muzdan og'irroqdir.Atmosfera bosimida hosil bo'ladigan va 0 ° C da eriydigan muz eng keng tarqalgan, ammo hali to'liq tushunilmagan moddadir. Uning tuzilishi va xususiyatlarida ko'p narsa g'ayrioddiy ko'rinadi. Muzning kristall panjarasi joylashgan joylarda kislorod atomlari tartibli joylashgan bo'lib, muntazam olti burchakli shakllarni hosil qiladi, ammo vodorod atomlari bog'lar bo'ylab turli xil pozitsiyalarni egallaydi. Atomlarning bunday xatti-harakati odatda atipikdir - qoida tariqasida, qattiq moddada hamma bir xil qonunga bo'ysunadi: yoki barcha atomlar tartibli joylashtirilgan, keyin u kristall yoki tasodifiy, keyin esa amorf moddadir.
Muz qanchalik g'alati eshitilmasin, erishi qiyin. Agar suv molekulalarini bir-biriga bog'lab turuvchi vodorod bog'lari bo'lmasa, u 90 ° C da eriydi. Shu bilan birga, suv muzlaganda, u ko'pgina ma'lum moddalarda bo'lgani kabi, hajmi kamaymaydi, lekin muzning ochiq tuzilishi tufayli ortadi.Muzning "g'alati jihatlari" uning o'sib borayotgan kristallari orqali elektromagnit nurlanishni ham o'z ichiga oladi. Qadimdan ma'lumki, suvda erigan aralashmalarning ko'p qismi o'sishni boshlaganda muzga o'tmaydi, boshqacha aytganda, muzlaydi. Shuning uchun, hatto eng iflos ko'lmakda ham muz plyonkasi toza va shaffof bo'ladi. Nopokliklar qattiq va suyuq muhitlar orasidagi chegarada, turli belgilardagi ikki qatlamli elektr zaryadlari ko'rinishida to'planadi, bu sezilarli potentsial farqni keltirib chiqaradi. Zaryadlangan aralashmalar qatlami yosh muzning pastki chegarasi bilan birga harakat qiladi va elektromagnit to'lqinlarni chiqaradi. Buning yordamida kristallanish jarayonini batafsil kuzatish mumkin. Shunday qilib, uzunligi igna shaklida o'sib borayotgan kristal lateral jarayonlar bilan qoplanganidan farqli ravishda chiqaradi va o'sayotgan donalarning nurlanishi kristallar yorilishi paytida sodir bo'ladigan narsadan farq qiladi. Radiatsiya impulslarining shakli, ketma-ketligi, chastotasi va amplitudasi bo'yicha muz qanday tezlikda muzlashini va qanday muz tuzilishini olishini aniqlash mumkin.
Noto'g'ri muz
Qattiq holatda suv, so'nggi ma'lumotlarga ko'ra, 14 ta strukturaviy modifikatsiyaga ega. Ulardan ba'zilari kristall (ularning ko'pchiligi), ba'zilari amorf, ammo ularning barchasi bir-biridan suv molekulalari va xossalarining nisbiy joylashishi bilan farq qiladi. To'g'ri, bizga tanish bo'lgan muzdan boshqa hamma narsa ekzotik sharoitda - juda past harorat va yuqori bosimlarda, suv molekulasidagi vodorod bog'lanish burchaklari o'zgarganda va olti burchakli bo'lmagan tizimlar hosil bo'lganda hosil bo'ladi. Misol uchun, 110 ° C dan past haroratlarda suv bug'i oktaedr va kub shaklida bir necha nanometr o'lchamdagi metall plastinkada cho'kadi - bu kub muz deb ataladi. Agar harorat 110 ° dan biroz yuqori bo'lsa va bug 'kontsentratsiyasi juda past bo'lsa, plastinkada juda zich amorf muz qatlami hosil bo'ladi.
XIII va XIV muzlarining so'nggi ikkita modifikatsiyasi Oksford olimlari tomonidan yaqinda, 2006 yilda kashf etilgan. Monoklinli va rombsimon panjarali muz kristallari mavjudligi haqidagi 40 yillik bashoratni tasdiqlash qiyin edi: 160 ° C haroratda suvning yopishqoqligi juda yuqori va juda toza o'ta sovutilgan suv molekulalari shunday miqdorda birlashadi. kristall yadro hosil qilish, qiyin. Katalizator yordam berdi: past haroratlarda suv molekulalarining harakatchanligini oshiradigan xlorid kislotasi. Muzning bunday modifikatsiyalari er yuzidagi tabiatda paydo bo'lishi mumkin emas, lekin ularni boshqa sayyoralarning muzlatilgan sun'iy yo'ldoshlarida izlash mumkin.
Komissiya shunday qaror qildiSnowflake - bu muzning yagona kristalli, olti burchakli kristall mavzusidagi o'zgarish, lekin muvozanatsiz sharoitda tez o'sadi. Eng qiziquvchan onglar asrlar davomida o'zlarining go'zalligi va cheksiz xilma-xilligi siri bilan kurashib keladi. Astronom Iogannes Kepler 1611 yilda "Olti burchakli qor parchalari haqida" to'liq risolasini yozgan. 1665 yilda Robert Xuk mikroskop bilan ko'rgan hamma narsaning katta hajmdagi eskizlarida turli shakldagi qor parchalarining ko'plab rasmlarini nashr etdi. Mikroskop ostida qor parchasining birinchi muvaffaqiyatli fotosurati 1885 yilda amerikalik fermer Uilson Bentli tomonidan olingan. O'shandan beri u to'xtata olmadi. Umrining oxirigacha, qirq yildan ko'proq vaqt davomida Bentley ularni suratga oldi. Besh mingdan ortiq kristallar va bittasi ham bir xil emas.
Bentley sababining eng mashhur izdoshlari - yuqorida aytib o'tilgan Ukihiro Nakaya va amerikalik fizik Kennet Libbrecht. Nakaya birinchi bo'lib qor parchalarining o'lchami va shakli havo harorati va namlik tarkibiga bog'liqligini aytdi va laboratoriya sharoitida turli shakldagi muz kristallarini o'stirish orqali bu farazni eksperimental tarzda yorqin tasdiqladi. Va Libbrecht hatto oldindan belgilangan shakldagi qor parchalarini o'stira boshladi.
Qor parchasining hayoti haroratning pasayishi bilan suv bug'lari bulutida kristalli muz yadrolari hosil bo'lishidan boshlanadi. Kristallanish markazi chang zarralari, har qanday qattiq zarralar yoki hatto ionlar bo'lishi mumkin, ammo har holda, o'lchami millimetrning o'ndan biridan kam bo'lgan bu muz qismlari allaqachon olti burchakli kristall panjaraga ega.
Ushbu yadrolar yuzasida kondensatsiyalanuvchi suv bug'i birinchi navbatda kichik olti burchakli prizma hosil qiladi, uning olti burchagidan butunlay bir xil muz ignalari va lateral jarayonlar o'sishni boshlaydi. Ular bir xil, chunki embrion atrofidagi harorat va namlik ham bir xil. Ularda, o'z navbatida, daraxtdagi kabi lateral kurtaklar va novdalar o'sadi. Bunday kristallar dendritlar deb ataladi, ya'ni yog'ochga o'xshaydi.
Bulutda yuqoriga va pastga harakatlanayotgan qor parchasi har xil harorat va suv bug'ining kontsentratsiyasiga ega bo'lgan sharoitlarga duch keladi. Uning shakli o'zgaradi, olti burchakli simmetriya qonunlariga oxirigacha bo'ysunadi. Qor parchalari shu tarzda boshqacha bo'ladi. Nazariy jihatdan, bir xil balandlikda bir xil bulutda, ular bir xil "paydo bo'lishi" mumkin. Ammo har birining erga o'z yo'li bor, bu juda uzun; o'rtacha qor parchasi soatiga 0,9 km tezlikda tushadi. Bu shuni anglatadiki, har birining o'z tarixi va o'zining yakuniy shakli mavjud. Qor parchasini hosil qiluvchi muz shaffof, ammo ular ko'p bo'lsa, quyosh nurlari ko'p yuzlarda aks ettirilgan va tarqalib, bizga oq shaffof massa taassurot qoldiradi - biz uni qor deb ataymiz.
Qor parchalarining xilma-xilligi bilan chalkashmaslik uchun 1951 yilda qor va muz bo'yicha Xalqaro komissiya muz kristallarining juda oddiy tasnifini qabul qildi: plitalar, yulduz kristallari, ustunlar yoki ustunlar, ignalar, fazoviy dendritlar, uchli ustunlar va tartibsiz shakllar. Va yana uchta muzli yog'ingarchilik: nozik qor granulalari, muz granulalari va do'l.Ayoz, muzlash va shishadagi naqshlarning o'sishi xuddi shu qonunlarga bo'ysunadi. Bu hodisalar, xuddi qor parchalari kabi, kondensatsiya, molekula molekula, erda, o'tda, daraxtlarda hosil bo'ladi. Derazadagi naqshlar sovuq havoda, issiq xona havosidan namlik shisha yuzasida kondensatsiyalanganda paydo bo'ladi. Ammo do'l suv tomchilari muzlaganda yoki suv bug'lari bilan to'yingan bulutlardagi muz qor parchalari embrionlarida zich qatlamlarda muzlaganda hosil bo'ladi. Boshqa, allaqachon hosil bo'lgan qor parchalari do'llarga muzlashi va ular bilan birlashishi mumkin, buning natijasida do'l eng g'alati shakllarni oladi.
Erdagi biz uchun suvning bitta qattiq modifikatsiyasi - oddiy muz etarli. U tom ma'noda inson yashashi yoki turar joyining barcha joylariga kiradi. Katta miqdorda to'plangan qor va muz alohida kristallar yoki qor parchalarinikidan tubdan farq qiladigan xususiyatlarga ega maxsus tuzilmalarni hosil qiladi. Tog' muzliklari, suv zonalarining muz qoplami, abadiy muzlik va oddiygina mavsumiy qor qoplami katta hududlar va butun sayyora iqlimiga sezilarli ta'sir ko'rsatadi: hatto qorni hech qachon ko'rmaganlar ham Yerning qutblarida to'plangan massalarining nafasini his qilishadi. masalan, Jahon okeani sathining uzoq muddatli tebranishlari shaklida. Muz sayyoramizning ko'rinishi va undagi tirik mavjudotlarning qulay yashash muhiti uchun shunchalik muhimki, olimlar uning uchun maxsus muhitni - atmosferaga yuqori va er qobig'iga chuqur kirib boradigan kriosferani ajratdilar.
Olga Maksimenko, kimyo fanlari nomzodi
Maxsus qidiruv
Suv tuzilishi
Ph.D. O.V. Mosin
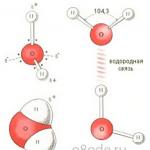
Suv molekulasi - bu qutblarida musbat va manfiy zaryadlarni o'z ichiga olgan kichik dipol. Kislorod yadrosining massasi va zaryadi vodorod yadrolarinikidan kattaroq bo'lgani uchun elektron buluti kislorod yadrosi tomon tortiladi. Bunda vodorod yadrolari ochiladi. Shunday qilib, elektron bulut bir xil bo'lmagan zichlikka ega. Vodorod yadrolari yaqinida elektron zichligi yetishmaydi, molekulaning qarama-qarshi tomonida, kislorod yadrosi yaqinida esa elektron zichligi ortiqcha bo'ladi. Aynan shu tuzilish suv molekulasining qutbliligini belgilaydi. Agar siz musbat va manfiy zaryadlarning epitsentrlarini to'g'ri chiziqlar bilan bog'lasangiz, siz uch o'lchamli geometrik shaklga ega bo'lasiz - muntazam tetraedr.
 Suv molekulasining tuzilishi (o'ngdagi rasm)
Suv molekulasining tuzilishi (o'ngdagi rasm)
Vodorod aloqalari mavjudligi tufayli har bir suv molekulasi 4 qo'shni molekula bilan vodorod bog'ini hosil qiladi va muz molekulasida ochiq to'rli ramka hosil qiladi. Biroq, suyuq holatda suv tartibsiz suyuqlikdir; Bu vodorod bog'lari o'z-o'zidan paydo bo'ladi, qisqa umr ko'radi, tezda buziladi va yana hosil bo'ladi. Bularning barchasi suv tarkibidagi heterojenlikka olib keladi.
 Suv molekulalari orasidagi vodorod aloqalari (chapdagi rasm)
Suv molekulalari orasidagi vodorod aloqalari (chapdagi rasm)
Suvning tarkibi jihatidan heterojen ekanligi uzoq vaqt oldin aniqlangan. Muzning suv yuzasida suzib yurishi, ya'ni kristalli muzning zichligi suyuqlik zichligidan kamroq ekanligi azaldan ma'lum.
Deyarli barcha boshqa moddalar uchun kristall suyuq fazaga qaraganda zichroqdir. Bundan tashqari, erishdan keyin ham, harorat oshishi bilan suvning zichligi o'sishda davom etadi va 4C da maksimal darajaga etadi. Suvning siqilish anomaliyasi kamroq ma'lum: erish nuqtasidan 40C gacha qizdirilganda u pasayadi va keyin ortadi. Suvning issiqlik sig'imi ham monoton bo'lmagan haroratga bog'liq.
Bundan tashqari, 30C dan past haroratlarda atmosfera bosimidan 0,2 GPa gacha ko'tarilishi bilan suvning yopishqoqligi pasayadi va suv molekulalarining bir-biriga nisbatan harakat tezligini belgilovchi parametr bo'lgan o'z-o'zidan diffuziya koeffitsienti ortadi.
Boshqa suyuqliklar uchun munosabatlar teskari bo'lib, deyarli hech qanday joyda ba'zi muhim parametrlar monoton bo'lmagan tarzda harakat qilmaydi, ya'ni. birinchi marta oshdi va harorat yoki bosimning kritik qiymatidan o'tgandan keyin kamaydi. Aslida suv bitta suyuqlik emas, balki xususiyatlari jihatidan farq qiluvchi ikki komponentning aralashmasi, masalan, zichlik va yopishqoqlik, shuning uchun tuzilish degan taxmin paydo bo'ldi. Bunday g'oyalar 19-asrning oxirida, suv anomaliyalari haqida ko'plab ma'lumotlar to'plangan paytda paydo bo'la boshladi.
Uayting birinchi bo'lib 1884 yilda suv ikki komponentdan iborat degan fikrni ilgari surgan. Uning muallifligi E.F.Fritsman tomonidan 1935 yilda nashr etilgan "Suvning tabiati. Og'ir suv" monografiyasida keltirilgan. 1891-yilda V.Rengten suvning zichligi bilan farq qiluvchi ikki holati tushunchasini kiritdi. Undan keyin ko'plab asarlar paydo bo'ldi, ularda suv turli xil tarkibdagi (gidrollar) assotsiatsiyalar aralashmasi sifatida ko'rib chiqildi.
1920-yillarda muzning tuzilishi aniqlanganda, kristall holatdagi suv molekulalari uch o'lchovli uzluksiz tarmoq hosil qiladi, unda har bir molekula muntazam tetraedrning uchlarida joylashgan to'rtta eng yaqin qo'shniga ega. 1933 yilda J. Bernal va P. Fauler suyuq suvda ham shunga o'xshash tarmoq mavjudligini taklif qilishdi. Suv muzdan zichroq bo'lganligi sababli, ular undagi molekulalar muzdagi kabi emas, ya'ni tridimit mineralidagi kremniy atomlari kabi emas, balki kremniy, kvartsning zichroq modifikatsiyasidagi kremniy atomlari kabi joylashtirilgan deb ishonishgan. 0 dan 4C gacha qizdirilganda suv zichligi oshishi past haroratlarda tridimit komponentining mavjudligi bilan izohlanadi. Shunday qilib, Bernal Fauler modeli ikki tuzilish elementini saqlab qoldi, ammo ularning asosiy yutug'i uzluksiz tetraedral tarmoq g'oyasi edi. Keyin I.Langmurning mashhur aforizmi paydo bo'ldi: "Okean bitta katta molekuladir". Modelning haddan tashqari spetsifikatsiyasi birlashgan tarmoq nazariyasi tarafdorlari sonini ko'paytirmadi.
Faqat 1951-yilgacha J. Pople uzluksiz grid modelini yaratdi, u Bernal Fauler modeli kabi o'ziga xos bo'lmagan. Popl suvni tasodifiy tetraedral tarmoq sifatida tasavvur qilgan, molekulalar orasidagi bog'lanishlar egri va turli uzunliklarga ega. Pople modeli suvning erish paytida siqilishini bog'larning egilishi bilan tushuntiradi. II va IX muzlar tuzilishining birinchi ta'riflari 60-70-yillarda paydo bo'lganida, bog'lanishlarning egilishi strukturaning siqilishiga qanday olib kelishi aniq bo'ldi. Poplening modeli suv xususiyatlarining harorat va bosimga monoton bo'lmagan bog'liqligini, shuningdek, ikki holatli modellarni tushuntira olmadi. Shu sababli, ikki davlat g'oyasi uzoq vaqt davomida ko'plab olimlar tomonidan baham ko'rilgan.
Ammo 20-asrning ikkinchi yarmida gidrollarning tarkibi va tuzilishi haqida ular asr boshidagi kabi tasavvur qilish mumkin emas edi. Muz va kristalli gidratlarning qanday ishlashi allaqachon ma'lum bo'lgan va ular vodorod aloqasi haqida ko'p narsalarni bilishgan. Kontinuum modellaridan tashqari (Pople modeli) aralash modellarning ikkita guruhi paydo bo'ldi: klaster va klatrat. Birinchi guruhda suv vodorod bog'lari bilan bog'langan molekulalar klasterlari shaklida paydo bo'ldi, ular bunday aloqalarda ishtirok etmaydigan molekulalar dengizida suzadi. Modellarning ikkinchi guruhi suvni bo'shliqlarni o'z ichiga olgan vodorod aloqalarining uzluksiz tarmog'i (odatda bu kontekstda ramka deb ataladi) sifatida ko'rib chiqdi; ular tarkibida ramka molekulalari bilan bog'lanmaydigan molekulalar mavjud. Suvning barcha xususiyatlarini, shu jumladan mashhur anomaliyalarni tushuntirish uchun klaster modellarining ikkita mikrofazasining xususiyatlari va konsentratsiyasini yoki ramkaning xususiyatlarini va uning bo'shliqlarini klatrat modellarini to'ldirish darajasini tanlash qiyin emas edi.
Klaster modellari orasida G. Nemeti va X. Sheragi modeli eng diqqatga sazovor bo'ldi.: Ular taklif qilgan, bog'lanmagan molekulalar dengizida suzuvchi bog'langan molekulalar klasterlarini tasvirlaydigan rasmlar ko'plab monografiyalarga kiritilgan.
Klatrat tipining birinchi modeli 1946 yilda O.Ya.Samoilov tomonidan taklif qilingan: suvda olti burchakli muzga o'xshash vodorod bog'lari tarmog'i saqlanib qolgan, uning bo'shliqlari qisman monomer molekulalari bilan to'ldirilgan. 1959 yilda L. Pauling boshqa variantni yaratdi, bu strukturaning asosi ba'zi kristalli gidratlarga xos bo'lgan bog'lanishlar tarmog'i bo'lishi mumkinligini ko'rsatdi.
60-yillarning ikkinchi yarmi va 70-yillarning boshlarida bu barcha qarashlarning yaqinlashishi kuzatildi. Klaster modellarining variantlari paydo bo'ldi, ularda ikkala mikrofazadagi molekulalar vodorod aloqalari bilan bog'langan. Klatrat modellari tarafdorlari bo'shliq va ramka molekulalari o'rtasida vodorod aloqalarining shakllanishini tan olishni boshladilar. Ya'ni, aslida, ushbu modellarning mualliflari suvni vodorod aloqalarining uzluksiz tarmog'i deb hisoblashadi. Va biz bu panjara qanchalik heterojen ekanligi haqida gapiramiz (masalan, zichlikda). Suvning vodorod bilan bog'langan klasterlari sifatida bog'lanmagan suv molekulalari dengizida suzuvchi g'oyasi saksoninchi yillarning boshlarida, G. Stenli suvning fazaviy o'tishlarini tavsiflovchi perkolatsiya nazariyasini qo'llaganida, barham topdi. suv modeli.
1999 yilda mashhur rus suv tadqiqotchisi S.V. Zenin Rossiya Fanlar akademiyasining Tibbiyot va biologik muammolar institutida klaster nazariyasi bo'yicha doktorlik dissertatsiyasini himoya qildi, bu tadqiqotning ushbu sohasini rivojlantirishda muhim qadam bo'ldi, uning murakkabligi ular tomonidan kuchaytirildi. Ular uchta fanning chorrahasida joylashgan: fizika, kimyo va biologiya. Uchta fizik-kimyoviy usul bilan olingan ma'lumotlarga asoslanib: refraktometriya (S.V. Zenin, B.V. Tyaglov, 1994), yuqori samarali suyuqlik xromatografiyasi (S.V. Zenin va boshqalar, 1998) va proton magnit-rezonansi (C. S. V. Zenin, 1993) geometrik konstruktsiyasi va isbotlangan. suv molekulalarining asosiy barqaror strukturaviy shakllanishi modeli (strukturali suv), so'ngra (S.V. Zenin, 2004) kontrast fazali mikroskop yordamida ushbu tuzilmalarning tasviri olingan.
 Ilm-fan shuni isbotladiki, suvning fizik xususiyatlarining o'ziga xos xususiyatlari va suv molekulasidagi qo'shni vodorod va kislorod atomlari o'rtasidagi ko'p sonli qisqa muddatli vodorod aloqalari suvni idrok etuvchi, saqlaydigan va uzatuvchi maxsus bog'langan tuzilmalarni (klasterlarni) shakllantirish uchun qulay imkoniyatlar yaratadi. turli xil ma'lumotlar.
Ilm-fan shuni isbotladiki, suvning fizik xususiyatlarining o'ziga xos xususiyatlari va suv molekulasidagi qo'shni vodorod va kislorod atomlari o'rtasidagi ko'p sonli qisqa muddatli vodorod aloqalari suvni idrok etuvchi, saqlaydigan va uzatuvchi maxsus bog'langan tuzilmalarni (klasterlarni) shakllantirish uchun qulay imkoniyatlar yaratadi. turli xil ma'lumotlar.
Bunday suvning strukturaviy birligi klatratlardan tashkil topgan klaster bo'lib, uning tabiati uzoq masofali Kulon kuchlari bilan belgilanadi. Klasterlarning tuzilishi ushbu suv molekulalari bilan sodir bo'lgan o'zaro ta'sirlar haqidagi ma'lumotlarni kodlaydi. Suv klasterlarida kislorod atomlari va vodorod atomlari orasidagi kovalent va vodorod aloqalari o'rtasidagi o'zaro ta'sir tufayli protonning (H +) migratsiyasi rele mexanizmi orqali sodir bo'lishi mumkin, bu esa klaster ichidagi protonning delokalizatsiyasiga olib keladi.
Har xil turdagi ko'plab klasterlardan tashkil topgan suv juda katta hajmdagi ma'lumotlarni idrok etishi va saqlashi mumkin bo'lgan ierarxik fazoviy suyuq kristalli tuzilmani hosil qiladi.
Rasmda (V.L. Voeikov) misol tariqasida bir nechta oddiy klaster tuzilmalarining diagrammalari ko'rsatilgan.
Suv klasterlarining ba'zi mumkin bo'lgan tuzilmalari

Har xil tabiatdagi fizik maydonlar axborot tashuvchisi bo'lishi mumkin. Shunday qilib, elektromagnit, akustik va boshqa maydonlardan foydalangan holda suvning suyuq kristalli strukturasining turli tabiatdagi ob'ektlar bilan masofaviy axborot o'zaro ta'siri imkoniyati o'rnatildi. Ta'sir etuvchi ob'ekt ham shaxs bo'lishi mumkin.
Suv o'ta zaif va zaif o'zgaruvchan elektromagnit nurlanish manbai hisoblanadi. Eng kam xaotik elektromagnit nurlanish tuzilgan suv tomonidan yaratiladi. Bunday holda, biologik ob'ektlarning strukturaviy va axborot xususiyatlarini o'zgartiradigan mos keladigan elektromagnit maydonning induksiyasi paydo bo'lishi mumkin.
So'nggi yillarda o'ta sovutilgan suvning xususiyatlari haqida muhim ma'lumotlar olindi. Past haroratlarda suvni o'rganish juda qiziq, chunki u boshqa suyuqliklarga qaraganda ko'proq sovutilishi mumkin. Suvning kristallanishi, qoida tariqasida, idishning devorlarida yoki qattiq aralashmalarning suzuvchi zarralarida ba'zi bir notekisliklardan boshlanadi. Shuning uchun, o'ta sovutilgan suvning o'z-o'zidan kristallanishi mumkin bo'lgan haroratni topish oson emas. Ammo olimlar buni uddalashdi va endi muz kristallari hosil bo'lishi butun hajm bo'ylab bir vaqtning o'zida sodir bo'lganda, bir hil yadrolanish deb ataladigan harorat 0,3 GPa gacha bo'lgan bosim bilan ma'lum, ya'ni mavjud bo'lgan hududlarni qamrab oladi. muz II.
Atmosfera bosimidan I va II muzlarni ajratuvchi chegaragacha bu harorat 231 dan 180 K gacha pasayadi, keyin esa 190 K gacha bir oz ortadi. Ushbu tanqidiy harorat ostida suyuq suv printsipial jihatdan mumkin emas.
Muz tuzilishi (o'ngdagi rasm)
 Biroq, bu harorat bilan bog'liq bir sir bor. Saksoninchi yillarning o'rtalarida amorf muzning yangi modifikatsiyasi - yuqori zichlikdagi muz kashf qilindi va bu ikki holatning aralashmasi sifatida suv g'oyasini jonlantirishga yordam berdi. Prototip sifatida kristalli tuzilmalar emas, balki turli xil zichlikdagi amorf muz tuzilmalari ko'rib chiqildi. Ushbu kontseptsiya eng aniq shaklda E.G.Ponyatovskiy va V.V.Sinitsin tomonidan 1999 yilda yozgan: "Suv ikki komponentning muntazam eritmasi sifatida ko'rib chiqiladi, mahalliy konfiguratsiyalar amorf muzning modifikatsiyasining qisqa muddatli tartibiga mos keladi. ”. Bundan tashqari, neytron diffraktsiya usullaridan foydalangan holda yuqori bosimdagi o'ta sovutilgan suvda qisqa masofali tartibni o'rganish orqali olimlar ushbu tuzilmalarga mos keladigan komponentlarni topishga muvaffaq bo'lishdi.
Biroq, bu harorat bilan bog'liq bir sir bor. Saksoninchi yillarning o'rtalarida amorf muzning yangi modifikatsiyasi - yuqori zichlikdagi muz kashf qilindi va bu ikki holatning aralashmasi sifatida suv g'oyasini jonlantirishga yordam berdi. Prototip sifatida kristalli tuzilmalar emas, balki turli xil zichlikdagi amorf muz tuzilmalari ko'rib chiqildi. Ushbu kontseptsiya eng aniq shaklda E.G.Ponyatovskiy va V.V.Sinitsin tomonidan 1999 yilda yozgan: "Suv ikki komponentning muntazam eritmasi sifatida ko'rib chiqiladi, mahalliy konfiguratsiyalar amorf muzning modifikatsiyasining qisqa muddatli tartibiga mos keladi. ”. Bundan tashqari, neytron diffraktsiya usullaridan foydalangan holda yuqori bosimdagi o'ta sovutilgan suvda qisqa masofali tartibni o'rganish orqali olimlar ushbu tuzilmalarga mos keladigan komponentlarni topishga muvaffaq bo'lishdi.
Amorf muzning polimorfizmi oqibati, shuningdek, past haroratli gipotetik kritik nuqtadan past haroratlarda suvning ikki aralashmaydigan komponentlarga bo'linishi haqidagi taxminlarga olib keldi. Afsuski, tadqiqotchilarning fikriga ko'ra, 0,017 GPa bosimdagi bu harorat yadrolanish haroratidan 230 K past, shuning uchun hali hech kim suyuq suvning tabaqalanishini kuzata olmagan. Shunday qilib, ikki davlat modelining qayta tiklanishi suyuq suvda vodorod aloqalari tarmog'ining heterojenligi masalasini ko'tardi. Bu heterojenlikni faqat kompyuter modellashtirish yordamida tushunish mumkin.
Suvning kristalli tuzilishi haqida gapirganda, shuni ta'kidlash kerakki, muzning 14 ta modifikatsiyasi ma'lum, ularning aksariyati tabiatda uchramaydi, bunda suv molekulalari ham individualligini saqlaydi, ham vodorod aloqalari bilan bog'lanadi. Boshqa tomondan, klatrat gidratlarda vodorod bog'lanish tarmog'ining ko'plab variantlari mavjud. Bu tarmoqlarning energiyalari (yuqori bosimli muzlar va klatrat gidratlar) kubik va olti burchakli muzlarning energiyalaridan unchalik yuqori emas. Shuning uchun bunday tuzilmalarning bo'laklari suyuq suvda ham paydo bo'lishi mumkin. Son-sanoqsiz turli xil davriy bo'lmagan qismlarni qurish mumkin, ularning molekulalari to'rtta eng yaqin qo'shnilari taxminan tetraedrning tepalarida joylashgan, ammo ularning tuzilishi muzning ma'lum modifikatsiyalari tuzilmalariga mos kelmaydi. Ko'p sonli hisob-kitoblar ko'rsatganidek, bunday bo'laklardagi molekulalarning o'zaro ta'sir energiyalari bir-biriga yaqin bo'ladi va suyuq suvda har qanday struktura ustun bo'lishi kerak deyishga asos yo'q.
Suvning strukturaviy tadqiqotlari turli usullar yordamida o'rganilishi mumkin; proton magnit-rezonans spektroskopiyasi, infraqizil spektroskopiya, rentgen nurlari difraksiyasi va boshqalar.Masalan, rentgen nurlari va neytronlarning difraksiyasi ko'p marta o'rganilgan. Biroq, bu tajribalar struktura haqida batafsil ma'lumot bera olmaydi. Zichligi boʻyicha bir-biridan farq qiluvchi bir jinsli boʻlmaganliklarni rentgen nurlari va neytronlarning kichik burchak ostida sochilishi orqali koʻrish mumkin edi, lekin bunday bir jinslilik yuzlab suv molekulalaridan tashkil topgan katta boʻlishi kerak. Yorug'likning tarqalishini o'rganish orqali ularni ko'rish mumkin edi. Biroq, suv juda shaffof suyuqlikdir. Difraksion tajribalarning yagona natijasi radial taqsimot funksiyasi, ya'ni kislorod, vodorod va kislorod-vodorod atomlari orasidagi masofadir. Ulardan ko'rinib turibdiki, suv molekulalarining joylashishida uzoq masofali tartib yo'q. Bu funksiyalar suv uchun boshqa suyuqliklarga qaraganda tezroq parchalanadi. Masalan, xona haroratiga yaqin haroratda kislorod atomlari orasidagi masofalarning taqsimlanishi faqat uchta maksimal, ya'ni 2,8, 4,5 va 6,7 ni beradi. Birinchi maksimal eng yaqin qo'shnilargacha bo'lgan masofaga to'g'ri keladi va uning qiymati taxminan vodorod aloqasining uzunligiga teng. Ikkinchi maksimal tetraedr chetining o'rtacha uzunligiga yaqin: olti burchakli muzdagi suv molekulalari markaziy molekula atrofida tasvirlangan tetraedrning uchlari bo'ylab joylashganligini unutmang. Va uchinchi maksimal, juda zaif ifodalangan, vodorod tarmog'idagi uchinchi va undan uzoqroq qo'shnilargacha bo'lgan masofaga to'g'ri keladi. Bu maksimalning o'zi juda yorqin emas va keyingi cho'qqilar haqida gapirishning hojati yo'q. Ushbu tarqatmalardan batafsilroq ma'lumot olishga urinishlar bo'ldi. Shunday qilib, 1969 yilda I.S.Andrianov va I.Z.Fisher sakkizinchi qo'shniga qadar bo'lgan masofalarni topdilar, beshinchi qo'shniga esa 3, oltinchi qo'shniga esa 3,1 ga teng bo'ldi. Bu suv molekulalarining uzoq muhiti haqida ma'lumot olish imkonini beradi.
Strukturani o'rganishning yana bir usuli - suv kristallaridagi neytron diffraktsiyasi - rentgen nurlari difraksiyasi bilan bir xil tarzda amalga oshiriladi. Biroq, neytronlarning tarqalish uzunligi turli atomlar o'rtasida unchalik katta farq qilmasligi sababli, izomorf almashtirish usuli qabul qilinishi mumkin emas. Amalda, odatda, molekulyar tuzilishi allaqachon boshqa usullar bilan aniqlangan kristal bilan ishlaydi. Keyinchalik bu kristal uchun neytron diffraktsiyasi intensivligi o'lchanadi. Ushbu natijalarga asoslanib, Fourier transformatsiyasi amalga oshiriladi, uning davomida vodorod bo'lmagan atomlarni hisobga olgan holda hisoblangan o'lchangan neytron intensivligi va fazalari qo'llaniladi, ya'ni. kislorod atomlari, ularning tuzilishi modelidagi joylashuvi ma'lum. Keyin, shu tarzda olingan Furye xaritasida vodorod va deyteriy atomlari elektron zichlik xaritasiga qaraganda ancha kattaroq og'irliklar bilan ifodalanadi, chunki bu atomlarning neytronlarning tarqalishiga qo'shgan hissasi juda katta. Ushbu zichlik xaritasidan foydalanib, siz, masalan, vodorod atomlarining (salbiy zichlik) va deyteriyning (musbat zichlik) o'rnini aniqlashingiz mumkin.
Ushbu usulning o'zgarishi mumkin, bu suvda hosil bo'lgan kristalning o'lchovlardan oldin og'ir suvda saqlanishidan iborat. Bunda neytron diffraksiyasi nafaqat vodorod atomlarining qayerda joylashganligini aniqlash imkonini beradi, balki ularning deyteriyga almashinadiganlarini ham aniqlaydi, bu ayniqsa izotop (H-D) almashinuvini o‘rganishda muhim ahamiyatga ega. Bunday ma'lumotlar strukturaning to'g'ri tashkil etilganligini tasdiqlashga yordam beradi.
Boshqa usullar ham suv molekulalarining dinamikasini o'rganish imkonini beradi. Bular kvazi-elastik neytronlarning tarqalishi, ultratezkor IQ spektroskopiyasi va NMR yoki etiketli deyteriy atomlari yordamida suv diffuziyasini o'rganish bo'yicha tajribalardir. NMR spektroskopiya usuli vodorod atomining yadrosi doimiy va o'zgaruvchan magnit maydonlar bilan o'zaro ta'sir qiluvchi magnit moment - spinga ega ekanligiga asoslanadi. NMR spektridan bu atomlar va yadrolar qanday muhitda joylashganligini aniqlash mumkin, shu bilan molekulaning tuzilishi haqida ma'lumot olish mumkin.
Suv kristallarida kvazelastik neytronlarning tarqalishi bo'yicha tajribalar natijasida eng muhim parametr - har xil bosim va haroratlarda o'z-o'zidan diffuziya koeffitsienti o'lchandi. Kvazielastik neytronlarning tarqalishidan o'z-o'zidan diffuziya koeffitsientini aniqlash uchun molekulyar harakatning tabiati haqida faraz qilish kerak. Agar ular Ya.I.Frenkelning (mashhur rus nazariy fizigi, "Suyuqliklarning kinetik nazariyasi" muallifi - ko'plab tillarga tarjima qilingan klassik kitob) modeliga muvofiq harakat qilsalar, "sakrashni kutish" modeli deb ham ataladi, u holda molekulaning turg'un hayot vaqti (sakrash orasidagi vaqt) 3,2 pikosekundga teng. Femtosekundli lazer spektroskopiyasining so'nggi usullari buzilgan vodorod aloqasining umrini taxmin qilish imkonini berdi: sherik topish uchun proton 200 fs kerak bo'ladi. Biroq, bularning barchasi o'rtacha qiymatlardir. Suv molekulalari harakatining tuzilishi va tabiati tafsilotlarini faqat kompyuter simulyatsiyasi yordamida o'rganish mumkin, ba'zan esa raqamli tajriba deb ataladi.

Kompyuterda modellashtirish natijalariga ko'ra suvning tuzilishi shunday ko'rinadi (kimyo fanlari doktori G. G. Malenkov bo'yicha). Umumiy tartibsiz tuzilmani ikki turdagi mintaqalarga bo'lish mumkin (qorong'i va engil sharlar sifatida ko'rsatilgan), ular tuzilishida, masalan, Voronoi ko'pburchak (a) hajmida, yaqin atrof-muhitning tetraedrallik darajasida (a). b), potentsial energiyaning qiymati (c), shuningdek, har bir molekulada to'rtta vodorod aloqasi mavjudligida (d). Biroq, bu joylar tom ma'noda bir lahzada, bir necha pikosekunddan keyin o'z joylarini o'zgartiradi.
Simulyatsiya shu tarzda amalga oshiriladi. Muz tuzilishi olinadi va eriguncha isitiladi. Keyin, suv o'zining kristalli kelib chiqishini unutishi uchun bir muncha vaqt o'tgach, lahzali mikrofotograflar olinadi.
Suv tuzilishini tahlil qilish uchun uchta parametr tanlanadi:
- molekulaning mahalliy muhitining muntazam tetraedr cho'qqilaridan og'ish darajasi;
-molekulalarning potentsial energiyasi;
-Voronoy ko'pburchak deb ataladigan hajm.
Ushbu ko'pburchakni qurish uchun berilgan molekuladan eng yaqiniga chekka olib, uni yarmiga bo'ling va shu nuqta orqali chetiga perpendikulyar tekislik o'tkazing. Bu har bir molekula hajmini beradi. Ko'pburchakning hajmi - zichlik, tetraedrallik - vodorod aloqalarining buzilish darajasi, energiya - molekulyar konfiguratsiyaning barqarorlik darajasi. Ushbu parametrlarning har birining qiymati o'xshash bo'lgan molekulalar alohida klasterlarga to'planishga moyil. Past zichlikli va yuqori zichlikli hududlar har xil energiya qiymatlariga ega, ammo ular bir xil energiya qiymatlariga ham ega bo'lishi mumkin. Tajribalar shuni ko'rsatdiki, turli tuzilishga ega bo'lgan hududlar, klasterlar o'z-o'zidan paydo bo'ladi va o'z-o'zidan parchalanadi. Suvning butun tuzilishi tirik va doimo o'zgarib turadi va bu o'zgarishlar sodir bo'ladigan vaqt juda qisqa. Tadqiqotchilar molekulalarning harakatlarini kuzatib borishdi va ular taxminan 0,5 ps chastotali va 1 angstrom amplitudali tartibsiz tebranishlarni amalga oshirishlarini aniqladilar. Pikosekundlarga cho'zilgan angstromlarning kamdan-kam sekin sakrashlari ham kuzatildi. Umuman olganda, 30 ps da molekula 8-10 angstrom harakatlanishi mumkin. Mahalliy muhitning umri ham qisqa. Voronoi ko'pburchakning hajmi o'xshash bo'lgan molekulalardan tashkil topgan hududlar 0,5 ps ichida parchalanishi yoki bir necha pikosekundlarda yashashi mumkin. Ammo vodorod aloqalarining umr bo'yi taqsimlanishi juda katta. Ammo bu vaqt 40 ps dan oshmaydi va o'rtacha qiymat bir necha ps.
Xulosa qilib shuni ta'kidlash kerakki Suvning klaster tuzilishi nazariyasi ko'plab tuzoqlarga ega. Masalan, Zenin suvning asosiy tuzilish elementi to'rt dodekaedrning birlashishi natijasida hosil bo'lgan 57 molekula klasteridir, deb taklif qiladi. Ularning umumiy yuzlari bor va ularning markazlari muntazam tetraedr hosil qiladi. Suv molekulalari beshburchakli dodekaedrning uchlarida joylashishi uzoq vaqtdan beri ma'lum; Bunday dodekaedr gaz gidratlarining asosidir. Shu sababli, suvda bunday tuzilmalar mavjudligini taxmin qilishda ajablanarli narsa yo'q, garchi hech qanday o'ziga xos tuzilma ustun bo'lishi va uzoq vaqt mavjud bo'lishi mumkin emasligi allaqachon aytilgan bo'lsa-da. Shuning uchun g'alati narsa, bu element asosiy hisoblanadi va u aniq 57 molekuladan iborat. To'plardan, masalan, bir xil tuzilmalarni yig'ishingiz mumkin, ular bir-biriga ulashgan dodekaedrlardan iborat va 200 molekuladan iborat. Zeninning ta'kidlashicha, suvning uch o'lchovli polimerizatsiya jarayoni 57 molekulada to'xtaydi. Uning fikricha, kattaroq sheriklar bo'lmasligi kerak. Biroq, agar shunday bo'lsa, vodorod aloqalari bilan bog'langan juda ko'p molekulalarni o'z ichiga olgan olti burchakli muz kristallari suv bug'idan cho'kmaga tusha olmaydi. Zenin klasterining o'sishi nima uchun 57 molekulada to'xtaganligi umuman aniq emas. Qarama-qarshiliklarga yo'l qo'ymaslik uchun Zenin klasterlarni deyarli ming molekuladan iborat bo'lgan murakkabroq shakllanishlarga - romboedralarga to'playdi va asl klasterlar bir-biri bilan vodorod aloqalarini hosil qilmaydi. Nega? Ularning yuzasidagi molekulalar ichidagi molekulalardan nimasi bilan farq qiladi? Zeninning fikricha, romboedrlar yuzasida gidroksil guruhlari naqshlari suvning xotirasini ta'minlaydi. Binobarin, bu yirik komplekslardagi suv molekulalari qattiq mahkamlangan, komplekslarning o'zi esa qattiq moddalardir. Bunday suv oqmaydi va uning molekulyar og'irligi bilan bog'liq erish nuqtasi juda yuqori bo'lishi kerak.
Zenin modeli suvning qanday xususiyatlarini tushuntiradi? Model tetraedral tuzilmalarga asoslanganligi sababli, u rentgen nurlari va neytron diffraktsiyasi ma'lumotlariga ko'proq yoki kamroq mos kelishi mumkin. Biroq, model erish paytida zichlikning pasayishini tushuntirishi dargumon, dodekaedrlarning o'rami muzdan kamroq zichroqdir. Ammo dinamik xususiyatlarga ega modelga rozi bo'lish eng qiyin - suyuqlik, o'z-o'zidan tarqalish koeffitsientining katta qiymati, qisqa korrelyatsiya va dielektrik relaksatsiya vaqtlari, ular pikosekundlarda o'lchanadi.
Ph.D. O.V. Mosin
Adabiyotlar:
G.G. Malenkov. Fizikaviy kimyo yutuqlari, 2001 yil
S.V.Zenin, B.M. Polanuer, B.V. Tyaglov. Suv fraksiyalari mavjudligining eksperimental isboti. G. Gomeopatik tibbiyot va akupunktur. 1997.No2.P.42-46.
S.V. Zenin, B.V. Tyaglov. Suv molekulalari assotsiatsiyalari tuzilishining gidrofobik modeli. J. Fizikaviy kimyo.1994. T. 68. No 4. B. 636-641.
S.V. Zenin Proton magnit-rezonans usuli yordamida suv tuzilishini o'rganish. Dokl.RAN.1993.T.332.No3.S.328-329.
S.V.Zenin, B.V.Tyaglov. Hidrofobik o'zaro ta'sirning tabiati. Suvli eritmalarda orientatsiya maydonlarining paydo bo'lishi. J. Fizikaviy kimyo.1994. T. 68. No 3. B. 500-503.
S.V. Zenin, B.V. Tyaglov, G.B.Sergeev, Z.A. Shabarova. NMR yordamida nukleotidamidlarning molekula ichidagi o'zaro ta'sirini o'rganish. II Butunittifoq konf. materiallari. Dinamik bo'yicha Stereokimyo. Odessa.1975.53-bet.
S.V. Zenin. Tirik tizimlarning xatti-harakatlari va xavfsizligini nazorat qilish uchun asos sifatida suvning tuzilgan holati. Tezis. Biologiya fanlari doktori. "Tibbiyot-biologik muammolar instituti" davlat ilmiy markazi ("IMBP" DSK). Himoyalangan 1999. 05. 27. UDC 577.32:57.089.001.66.207 p.
IN VA. Slesarev. Tadqiqotning borishi haqida hisobot
nomidagi Tambov davlat universiteti. GR. Derjavina
Soros Educational Journal, 6-jild, № 9, 2000 yil
Suv va muz: biz ular haqida etarli ma'lumotga egamizmi?
Yu. I. GOLOVIN
Suv va muzning fizik xususiyatlari tasvirlangan. Bu moddalardagi turli hodisalarning mexanizmlari muhokama qilinadi. Uzoq vaqt davomida o'rganish va oddiy kimyoviy tarkibga qaramay, suv va muz - er yuzidagi hayot uchun juda qimmatli moddalar - ularning murakkab dinamik proton va molekulyar tuzilishi tufayli ko'plab sirlarni o'z ichiga oladi.Suv va muzning fizik xossalari haqida qisqacha ma’lumot berilgan. Ulardagi turli hodisalarning mexanizmlari ko'rib chiqiladi. Ko'p asrlik o'rganish tarixiga qaramay, eng oddiy kimyoviy tarkibi va Yerdagi hayot uchun alohida ahamiyatga ega bo'lishiga qaramay, suv va muzning tabiati murakkab dinamik proton va molekulyar tuzilish tufayli ko'plab sirlarga to'la.
Odamlarga oddiylik ko'proq kerak bo'lsa-da,
Shunga qaramay, ular uchun kompleks tushunarli.
B.L. Parsnip
Ehtimol, Yerda suyuq va qattiq fazalardagi suvdan ko'ra kengroq va ayni paytda sirliroq modda yo'qdir. Darhaqiqat, barcha tirik mavjudotlar suvdan kelib chiqqanligini va uning 50% dan ko'prog'ini tashkil etishini, Yer yuzasining 71% suv va muz bilan qoplanganini, shimoliy quruqlik maydonlarining muhim qismini abadiy muzlikdan tashkil etishini yodda tutish kifoya. Sayyoramizdagi muzning umumiy miqdorini tasavvur qilish uchun shuni ta'kidlaymizki, agar ular erisa, Jahon okeanidagi suv 50 m dan ko'proq ko'tariladi va bu butun dunyo bo'ylab ulkan quruqliklarni suv bosishiga olib keladi. Koinotda, shu jumladan Quyosh tizimida juda katta muz massalari topilgan. Suv ishlatilmaydigan biron bir ko'p yoki kamroq muhim ishlab chiqarish yoki inson faoliyati yo'q. So'nggi o'n yilliklarda tabiiy uglevodorodlarning qattiq muzga o'xshash gidratlari ko'rinishida katta yoqilg'i zaxiralari topildi.
Shu bilan birga, so'nggi yillarda suvning fizikasi va fizik kimyosidagi ko'plab muvaffaqiyatlardan so'ng, bu oddiy moddaning xususiyatlari to'liq tushunarli va oldindan aytib bo'ladigan deb aytish qiyin. Ushbu maqolada suv va muzning eng muhim fizik xususiyatlari va asosan ularning past haroratli holatlari fizikasi bilan bog'liq hal qilinmagan muammolar haqida qisqacha ma'lumot berilgan.
Bu murakkab molekula
Suvning fizik kimyosi haqidagi zamonaviy tushunchaning asoslari taxminan 200 yil oldin Genri Kavendish va Antuan Lavuazye tomonidan qo'yilgan bo'lib, ular suv o'rta asr alkimyogarlari ishonganidek oddiy kimyoviy element emas, balki kislorod va vodorod birikmasi ekanligini aniqladilar. ma'lum nisbat. Darhaqiqat, suvni tug'diradigan vodorod (vodorod) faqat ushbu kashfiyotdan keyin o'z nomini oldi va suv hozirgi kunda har bir maktab o'quvchisiga ma'lum bo'lgan H 2 O zamonaviy kimyoviy nomini oldi.
Shunday qilib, H 2 O molekulasi ikkita vodorod atomi va bitta kislorod atomidan qurilgan. Suvning optik spektrlarini o'rganish natijasida aniqlanganidek, harakatning to'liq yo'qligi (tebranishlarsiz va aylanishlarsiz) gipotetik holatda vodorod va kislorod ionlari kislorod egallagan uchburchakda burchak bilan teng yonli uchburchakning uchlarida pozitsiyalarni egallashi kerak. ning 104,5 ° (1-rasm, a). Qo'zg'atmagan holatda H + va O 2− ionlari orasidagi masofa 0,96 Å ga teng. Ushbu tuzilish tufayli suv molekulasi dipoldir, chunki O 2− ioni joylashgan hududdagi elektron zichligi H + ionlari mintaqasiga qaraganda ancha yuqori va eng oddiy model - sharlar modeli - suvning xossalarini tavsiflash uchun juda mos emas. Protonlar joylashgan sohada ikkita kichik shish paydo bo'lgan to'p shaklida suv molekulasini tasavvur qilishingiz mumkin (1-rasm, b). Biroq, bu suvning yana bir xususiyatini - molekulalar o'rtasida yo'naltirilgan vodorod aloqalarini shakllantirish qobiliyatini tushunishga yordam bermaydi, bu uning bo'sh, ammo ayni paytda juda barqaror fazoviy tuzilishini shakllantirishda katta rol o'ynaydi, bu esa suvning ko'p qismini belgilaydi. suyuq va qattiq holatda ham jismoniy xususiyatlar.
Guruch. 1. H 2 O monomerining geometrik diagrammasi (a), tekis modeli (b) va fazoviy elektron tuzilishi (c) Kislorod atomining tashqi qobig'idagi to'rtta elektrondan ikkitasi vodorod atomlari bilan kovalent bog'lanishni yaratishda ishtirok etadi va qolgan ikkitasi H-O-H tekisligiga perpendikulyar bo'lgan juda cho'zilgan elektron orbitalarini hosil qiladi.
Eslatib o'tamiz, vodorod aloqasi - bu vodorod atomi orqali sodir bo'ladigan bir molekula yoki qo'shni molekuladagi atomlar o'rtasidagi bog'lanish. U kovalent va novalent bog'lar o'rtasida oraliq pozitsiyani egallaydi va vodorod atomi ikkita elektron manfiy atomlar (O, N, F va boshqalar) o'rtasida joylashganda hosil bo'ladi. H atomidagi elektron proton bilan nisbatan zaif bog'langan, shuning uchun maksimal elektron zichligi ko'proq elektron manfiy atomga o'tadi va proton ta'sir qiladi va boshqa elektron manfiy atom bilan o'zaro ta'sir qila boshlaydi. Bunda O⋅⋅⋅O, N⋅⋅⋅O atomlari va boshqalar bir-biriga yaqinlashadi. H atomi bo'lmaganida ular o'rtasida o'rnatiladigan masofaga yaqin masofaga.Vodorod bog'lanishi nafaqat suvning tuzilishini belgilaydi, balki biomolekulalar: oqsillar, uglevodlar, nuklein kislotalar va boshqalar hayotida juda muhim rol o'ynaydi. .
Shubhasiz, suvning tabiatini tushuntirish uchun uning molekulalarining elektron tuzilishini hisobga olish kerak. Ma'lumki, kislorod atomining yuqori qobig'ida to'rtta elektron, vodorod esa faqat bitta elektronga ega. Har bir kovalent O-H aloqasining hosil bo'lishi kislorod va vodorod atomlaridan bitta elektronni o'z ichiga oladi. Kislorodda qolgan ikkita elektron yakka juftlik deb ataladi, chunki ular izolyatsiyalangan suv molekulasida H 2 O molekulasi ichida bog'lanish hosil bo'lishida ishtirok etmasdan erkin bo'lib qoladilar.Ammo boshqa molekulalarga yaqinlashganda, aynan shu yolg'iz elektronlar o'ynaydi. suvning molekulyar tuzilishini shakllantirishda hal qiluvchi rol o'ynaydi.
Yagona elektronlar O–H bogʻlari bilan itariladi, shuning uchun ularning orbitalari vodorod atomlariga qarama-qarshi yoʻnalishda kuchli choʻzilgan va orbital tekisliklari O–H–O bogʻlari hosil qilgan tekislikka nisbatan aylanadi. Shunday qilib, suv molekulasini uch o'lchovli koordinatali fazoda tasvirlash to'g'riroq bo'ladi xyz tetraedr shaklida, uning markazida kislorod atomi va ikkita uchida vodorod atomi joylashgan (1-rasm, s). H 2 O molekulalarining elektron tuzilishi ularning suv va muzdagi vodorod aloqalarining murakkab uch o'lchovli tarmog'iga birlashishi shartlarini belgilaydi. Protonlarning har biri boshqa molekulaning yolg'iz elektroni bilan bog' hosil qilishi mumkin. Birinchi molekula akseptor, ikkinchisi esa donor vazifasini bajarib, vodorod aloqasini hosil qiladi. Har bir H2O molekulasi ikkita proton va ikkita yolg'iz elektronga ega bo'lganligi sababli, u bir vaqtning o'zida boshqa molekulalar bilan to'rtta vodorod aloqasi hosil qilishi mumkin. Shunday qilib, suv birikmalarning dinamik tabiatiga ega bo'lgan murakkab bog'langan suyuqlikdir va uning xususiyatlarini molekulyar darajada tavsiflash faqat turli darajadagi murakkablik va qattiqlikdagi kvant mexanik modellari yordamida mumkin.
Muz va uning xususiyatlari
Oddiy odam nuqtai nazaridan, muz qayerda paydo bo'lishidan qat'i nazar, ko'proq yoki kamroq bir xil bo'ladi: atmosferada do'l, tomlarning chekkasida muzdek yoki suv havzalarida plastinka. Jismoniy nuqtai nazardan, muzning molekulyar va mezoskopik tuzilishi bilan farq qiluvchi ko'plab navlari mavjud. Oddiy bosimda mavjud bo'lgan muzda har bir H 2 O molekulasi boshqa to'rtta bilan o'ralgan, ya'ni strukturaning koordinatsion soni to'rtta (muz I h deb ataladi). Tegishli kristall panjara - olti burchakli - mahkam o'ralgan emas, shuning uchun oddiy muzning zichligi (~ 0,9 g / sm 3) suv zichligidan (~ 1 g / sm 3) past, uning tuzilishi uchun Rentgen nurlari diffraktsiyasi tadqiqotlari shuni ko'rsatadiki, o'rtacha koordinatsiya soni ~ 4,4 (muz I h uchun 4 ga nisbatan). Muz tuzilishida faqat kislorod atomlari qattiq pozitsiyalarni egallaydi. Ikki vodorod atomi H 2 O molekulasining boshqa qo'shnilar bilan to'rtta bog'lanishida turli pozitsiyalarni egallashi mumkin. Panjaraning olti burchakliligi tufayli erkin holatda o'sadigan kristallar (masalan, qor parchalari) olti burchakli shaklga ega.
Biroq, olti burchakli faza muz mavjudligining yagona shaklidan uzoqdir. Boshqa kristall fazalarning aniq soni - muzning polimorf shakllari - hali ham noma'lum. Ular yuqori bosim va past haroratlarda hosil bo'ladi (2-rasm). Ba'zi tadqiqotchilar bunday fazalarning 12 tasi mavjudligini aniq belgilangan deb hisoblashadi, boshqalari esa ularni 14 tagacha hisoblashadi. Albatta, bu polimorfizmga ega bo'lgan yagona modda emas (masalan, kimyoviy jihatdan bir xil uglerod atomlaridan tashkil topgan grafit va olmosni eslang. ), ammo hozirgi kungacha kashf qilinayotgan muzning turli bosqichlari soni hayratlanarli. Yuqorida aytilganlarning barchasi muzning kristall panjarasida kislorod ionlarining tartibli joylashishi bilan bog'liq. Protonlarga kelsak - vodorod ionlari - neytron diffraktsiyasi bilan ko'rsatilgandek, ularning joylashishida kuchli tartibsizlik mavjud. Shunday qilib, kristal muz ham yaxshi tartiblangan muhit (kislorodga nisbatan) va bir vaqtning o'zida tartibsiz muhit (vodorodga nisbatan) hisoblanadi.

Guruch. 2. Kristalli muzning faza diagrammasi.
Rim raqamlari mavjud bo'lgan hududlarni ko'rsatadi
barqaror fazalarning shakllanishi. Ice IV metastabil fa-
uchun, V maydoni ichidagi diagrammada joylashgan
Ko'pincha muz egiluvchan va suyuq bo'lib tuyuladi. Agar harorat erish nuqtasiga yaqin bo'lsa (ya'ni atmosfera bosimida t = 0 ° C) va yuk uzoq vaqt davomida qo'llanilsa, bu to'g'ri. Va erish nuqtasiga yaqin haroratlarda eng qattiq material (masalan, metall) xuddi shunday yo'l tutadi. Muzning plastik deformatsiyasi, shuningdek, boshqa ko'plab kristalli qattiq jismlar singari, kristall orqali turli tuzilish kamchiliklari: vakansiyalar, oraliq atomlar, don chegaralari va eng muhimi, dislokatsiyalarning yadrolanishi va harakati natijasida yuzaga keladi. Asrimizning 30-yillarida aniqlanganidek, aynan ikkinchisining mavjudligi kristalli qattiq jismlarning plastik deformatsiyaga chidamliligining keskin pasayishini oldindan belgilab beradi (ideal panjaraning qarshiligiga nisbatan 10 2-10 4 marta). Hozirgacha muz Ihda olti burchakli tuzilishga xos boʻlgan barcha turdagi dislokatsiyalar aniqlangan va ularning mikromexanik va elektr xarakteristikalari oʻrganilgan.
Deformatsiya tezligining monokristalli muzning mexanik xususiyatlariga ta'siri rasmda yaxshi ko'rsatilgan. 3, N. Maeno kitobidan olingan. Ko'rinib turibdiki, deformatsiya tezligining oshishi bilan plastik oqim uchun zarur bo'lgan mexanik kuchlanishlar s tez ortib boradi va nisbiy deformatsiya E ning s ga bog'liqligida ulkan oqish tishi paydo bo'ladi.

Guruch. 3.(Tomonidan). t = -15 ° S da (siqish o'qiga 45 ° burchak ostida yo'naltirilgan bazal tekislik bo'ylab siljish) yagona muz kristalli I h uchun stressga nisbatan deformatsiya egri chiziqlari. Egri chiziqlardagi raqamlar nisbiy deformatsiya tezligini ko'rsatadi ( ∆l- namuna uzunligining o'zgarishi l davomida ∆τ
) 10 −7 s −1 birliklarida

Guruch. 4. Muzning proton quyi tizimidagi nuqsonlarning hosil bo'lish sxemasi: a - H 3 O + va OH - ion nuqsonlari juftligi; b – juft orientatsion Bjerrum nuqsonlari D va L
Muzning elektr xususiyatlari bundan kam emas. O'tkazuvchanlik kattaligi va harorat oshishi bilan uning eksponent tez o'sishi muzni metall o'tkazgichlardan keskin ajratib turadi va uni yarim o'tkazgichlar bilan tenglashtiradi. Muz odatda juda kimyoviy jihatdan toza, hatto iflos suv yoki eritmadan o'ssa (iflos ko'lmakdagi toza, shaffof muz bo'laklarini o'ylab ko'ring). Bu muz tarkibidagi aralashmalarning past eruvchanligi bilan bog'liq. Natijada, muzlatish paytida, aralashmalar kristallanish jabhasida suyuqlikka suriladi va muz tuzilishiga kirmaydi. Shuning uchun yangi tushgan qor har doim oq bo'lib, undan suv juda toza.
Tabiat oqilona ravishda Yer atmosferasida ulkan suv tozalash stantsiyasini taqdim etdi. Shuning uchun, muzdagi yuqori nopoklik o'tkazuvchanligiga (masalan, doplangan kremniy kabi) ishonish mumkin emas. Ammo unda metallardagi kabi erkin elektronlar yo'q. Faqat 20-asrning 50-yillarida muzdagi zaryad tashuvchilar tartibsiz protonlar, ya'ni muz proton yarim o'tkazgich ekanligi aniqlandi.
Yuqorida aytib o'tilgan protonning sakrashi muz tuzilishida ikki turdagi nuqsonlarni keltirib chiqaradi: ionli va orientatsion (4-rasm). Birinchi holda, bir H 2 O molekulasidan ikkinchisiga vodorod bog'i bo'ylab proton sakrashi sodir bo'ladi (4-rasm, a), natijada H 3 O + va OH - juft ion nuqsonlari hosil bo'ladi va ikkinchidan - bitta H 2 O molekulasidagi qo'shni vodorod bog'iga (4-rasm, b), buning natijasida L va D-defektlar deb ataladigan bir juft orientatsion Bjerrum nuqsonlari paydo bo'ladi (nemis tilidan leer - bo'sh va doppelt - qo'sh). ). Rasmiy ravishda bunday sakrashni H 2 O molekulasining 120 ° ga aylanishi deb hisoblash mumkin.
Faqat ionli yoki faqat orientatsion nuqsonlarning harakati tufayli to'g'ridan-to'g'ri oqim oqimi mumkin emas. Agar, masalan, H 3 O + ioni to'rning qaysidir qismidan o'tsa, keyingi o'xshash ion ham xuddi shu yo'ldan o'ta olmaydi. Biroq, agar bu yo'l bo'ylab D-nuqson o'tkazilsa, protonlarning joylashuvi asl holatiga qaytadi va shuning uchun keyingi H 3 O + ioni o'tishi mumkin bo'ladi. OH - va L nuqsonlari ham xuddi shunday harakat qiladi, shuning uchun kimyoviy toza muzning elektr o'tkazuvchanligi soni kichikroq bo'lgan nuqsonlar, ya'ni ionlar bilan chegaralanadi. Dielektrik qutblanish, aksincha, ko'proq orientatsion Bjerrum nuqsonlari bilan bog'liq. Aslida, tashqi elektr maydoni qo'llanilganda, ikkala jarayon ham parallel ravishda sodir bo'ladi, bu esa muzning to'g'ridan-to'g'ri oqim o'tkazishiga va bir vaqtning o'zida kuchli dielektrik qutblanishni boshdan kechirishga imkon beradi, ya'ni yarimo'tkazgichning xususiyatlarini ham, uning xususiyatlarini ham namoyon qiladi. izolyator. So'nggi yillarda sof muzning ferroelektrik va piezoelektrik xususiyatlarini past haroratlarda ham massaviy, ham fazalararo chegaralarda aniqlashga urinishlar davom etmoqda. Ularning mavjudligiga hali to'liq ishonch yo'q, garchi dislokatsiyalar va boshqa strukturaviy nuqsonlar mavjudligi bilan bog'liq bir nechta psevdo-piezoelektrik effektlar aniqlangan.
Muz yuzasi va kristallanish fizikasi
So'nggi o'n yillikda yarimo'tkazgichlar texnologiyasining rivojlanishi, elementlar bazasini mikrominiatizatsiyalash va planar texnologiyalarga o'tish munosabati bilan sirt fizikasiga qiziqish sezilarli darajada oshdi. Qattiq jismlardagi sirtga yaqin holatlarni o‘rganish uchun ko‘plab murakkab texnikalar ishlab chiqilgan bo‘lib, ular metallar, yarim o‘tkazgichlar va dielektriklarni o‘rganishda foydali ekanligi isbotlangan. Biroq, bug 'yoki suyuqlikka qo'shni muz yuzasining tuzilishi va xususiyatlari asosan noaniq bo'lib qolmoqda. M. Faraday tomonidan ilgari surilgan eng qiziq farazlardan biri muz yuzasida hatto erish nuqtasidan ancha past haroratda ham qalinligi o‘ndan yuzlab angstromgacha bo‘lgan yarim suyuq qatlamning mavjudligidir. Buning asosi nafaqat yuqori qutblangan H 2 O molekulalarining sirtga yaqin qatlamlari tuzilishining spekulyativ konstruktsiyalari va nazariyalari, balki muz yuzasining fazaviy holatini nozik aniqlash (yadro magnit rezonansi yordamida), shuningdek, uning sirt o'tkazuvchanligi va uning haroratga bog'liqligi. Biroq, eng amaliy jihatdan muhim hollarda, qor va muzning sirt xususiyatlari, ehtimol, kvazi-suyuq qatlam emas, balki suvning makroskopik plyonkasi mavjudligi bilan belgilanadi.
Muzning sirt qatlamlarini quyosh nuri, issiqroq atmosfera yoki uning ustida sirpanib yuradigan qattiq jism (konki, chang'i, chanalar) ta'sirida erishi past ishqalanish koeffitsientiga erishish uchun juda muhimdir. Kam toymasin ishqalanish, tez-tez o'ylanganidek, ko'tarilgan bosim ta'sirida erish haroratining pasayishi natijasi emas, balki ishqalanish issiqligining chiqishi natijasidir. Hisob-kitoblar shuni ko'rsatadiki, bosimning ta'siri, hatto 1 MPa ga yaqin bosim paydo bo'ladigan muz ustida keskin o'tkir konkida sirpanishda ham erish haroratining atigi ~ 0,1 ° C ga pasayishiga olib keladi, bu esa erishi mumkin emas. ishqalanish miqdoriga sezilarli ta'sir qiladi.
Suv va muzning xususiyatlarini tavsiflashda o'rnatilgan an'ana bu moddani gomologlari (H 2 S, H 2 Se, H 2 Te) orasida ajratib turadigan ko'plab anomal xususiyatlarni bayon qilish va muhokama qilishdir. Ehtimol, eng muhimi, juda yuqori (oddiy moddalar orasida) o'ziga xos termoyadroviy issiqlik (kristallanish) va issiqlik sig'imi, ya'ni muzning erishi qiyin, suvning muzlashi qiyin. Natijada, bizning sayyoramizdagi iqlim odatda juda yumshoq, ammo suv yo'qligida (masalan, issiq Afrika cho'llarida) kunduzi va tungi harorat o'rtasidagi kontrast bir vaqtning o'zida okean sohillariga qaraganda ancha yuqori. kenglik. Kristallanish jarayonida hajmning ko'payishi va ma'lum bo'lgan moddalarning aksariyati kabi kamaymasligi biosfera uchun muhim ahamiyatga ega. Natijada, muz cho'kishdan ko'ra suvda suzib yuradi va sovuq havoda suv havzalarining muzlashini sezilarli darajada sekinlashtiradi, qish uchun unda panoh topgan barcha tirik mavjudotlarni himoya qiladi. Bunga harorat 0°C ga tushganda suv zichligining monoton bo'lmagan o'zgarishi ham yordam beradi - bu suvning eng mashhur anomal xususiyatlaridan biri, bundan 300 yil oldin kashf etilgan. Maksimal zichlikka t = 4 ° C da erishiladi va bu 4 ° C dan past haroratgacha sovigan suvning er yuzasiga yaqin qatlamlarini pastga tushishiga yo'l qo'ymaydi. Suyuqlikning konvektiv aralashuvi bloklanadi, bu esa keyingi sovutishni sezilarli darajada sekinlashtiradi. Suvning boshqa anomaliyalari juda uzoq vaqtdan beri ma'lum: 20 ° C da kesish yopishqoqligi, 40 ° C da solishtirma issiqlik, 46 ° C da izotermik siqilish, 60 ° S da tovush tezligi. Suvning yopishqoqligi bosimning oshishi bilan kamayadi va boshqa suyuqliklar kabi oshmaydi. Ko'rinib turibdiki, suvning anomal xususiyatlari uning molekulasining strukturaviy xususiyatlari va molekulalararo o'zaro ta'sirlarning o'ziga xos xususiyatlari bilan bog'liq. Ikkinchisi bo'yicha to'liq aniqlik hali erishilmagan. Yuqorida tavsiflangan xususiyatlar termodinamik muvozanat sharoitida mavjud bo'lgan suv, muz va ular orasidagi interfeysga taalluqlidir. Murakkablikning mutlaqo boshqacha darajasidagi muammolar, ayniqsa, termodinamik muvozanatdan uzoqda bo'lgan sharoitlarda suv-muz fazasi o'tish dinamikasini tasvirlashga harakat qilganda paydo bo'ladi.
Har qanday fazali o'tishning termodinamik sababi zarrachalarning kimyoviy potentsiallarining bir tomonida, ikkinchisi esa interfeysning ∆µ = µ 1 -µ 2 farqidir. Kimyoviy potentsial m - tizimdagi N zarrachalar soni o'zgarganda termodinamik potensiallarning o'zgarishini aniqlaydigan holat funksiyasi, ya'ni m = G/N, bu erda G = H - TS - Gibbs termodinamik potensiali, H - entalpiya, S. entropiya, T - harorat. Termodinamik potentsiallarning farqi makroskopik jarayonning harakatlantiruvchi kuchidir (xuddi o'tkazgichning uchlaridagi elektr potensiallarining farqi elektr tokining sababi bo'lgani kabi). µ1 = µ2 da ikkala faza ham istalgancha muvozanatda yashashi mumkin. Oddiy bosimda suvning kimyoviy potentsiali t = 0 ° S da muzning kimyoviy potentsialiga teng. t da< 0°С более низким химическим потенциалом обладает лед, но это еще не означает, что при любом, самом маленьком переохлаждении начнется кристаллизация. Опыт показывает, что тщательно очищенный от примесей, обезгаженный, деионизированный расплав может быть переохлажден относительно точки равновесия фаз на десятки кельвин (а для некоторых веществ и на сотни). Анализ показывает, что причина заключается в отсутствии зародышей новой фазы (центров кристаллизации, конденсации, парообразования и т.д.).
Embrionlar ham bir jinsli, ya'ni metastabil holatda bo'lgan muhitning o'zidan shakllanishi mumkin, ammo buning uchun ma'lum shartlar bajarilishi kerak. Kristal va eritma (yoki bug ', eritma) o'rtasidagi har qanday interfeys Sa qo'shimcha energiyani kiritishini hisobga olgan holda vaziyatni ko'rib chiqishni boshlaylik, bu erda S - chegara maydoni, a - sirt energiyasi. Bundan tashqari, urug 'kristalini hosil qilgan N molekulalar suyuqlikdagidan N∆µ ga kam energiyaga ega. Natijada, yadro paydo bo'lganda tizimdagi energiyaning umumiy o'zgarishi ∆U = −N∆µ + Sa monotonik bo'lmagan N ga bog'liq bo'ladi. Darhaqiqat, yadroning sharsimon shakli uchun
![]()
Bu erda A = (36pV 2) 1/3 V - kristalldagi bitta molekula hajmi. Avvalgidan kelib chiqadiki, yadroda N c = (2Aa/3∆µ) 3 molekula mavjud bo'lganda, ∆U maksimal ∆Uc = - N c ∆µ + AN c 2/3 a ga etadi.
Shunday qilib, yadroga molekulalarning ketma-ket qo'shilishi bilan tizim birinchi navbatda super sovutishga qarab ∆U c balandlikdagi potentsial tepalikning tepasiga ko'tarilishi kerak, shundan so'ng kristalldagi N ning keyingi o'sishi uning pasayishi bilan sodir bo'ladi. energiya, ya'ni osonroq. Suyuqlikning harorati qanchalik past bo'lsa, ya'ni super sovutish qanchalik kuchli bo'lsa, kristallanish tezroq sodir bo'lishi kerak. Bu, aslida, hipotermiya juda katta bo'lmaganda sodir bo'ladi. Biroq t kamayishi bilan suyuqlikning qovushqoqligi ham eksponensial ravishda oshib, molekulalarning harakatlanishini qiyinlashtiradi. Natijada, o'ta sovutishning yuqori darajasida kristallanish jarayoni ko'p yillar davomida cho'zilishi mumkin (turli xil kelib chiqadigan ko'zoynaklarda bo'lgani kabi).
Raqamli hisob-kitoblar shuni ko'rsatadiki, tabiiy sharoitda (∆t = 1-10 ° C) normal darajada sovigan suv uchun embrion bir necha o'nlab molekulalardan iborat bo'lishi kerak, bu suyuqlik fazasidagi koordinatsion raqamdan sezilarli darajada kattaroqdir (~ 4,4). ). Shunday qilib, tizim energiya tepaligining tepasiga ko'tarilish uchun juda ko'p dalgalanma urinishlarini talab qiladi. Juda ham yaxshilab tozalanmagan suvda kuchli o'ta sovutish allaqachon mavjud kristallanish markazlarining mavjudligi bilan oldini oladi, ular nopoklik zarralari, chang zarralari, idish devorlarining notekisligi va boshqalar bo'lishi mumkin. Keyinchalik, kristall o'sishi kinetikasi sharoitga bog'liq. Fazalararo chegaraga yaqin issiqlik uzatish, shuningdek, atom darajasida ikkinchisining morfologiyasi bo'yicha.molekulyar darajada.
Qattiq o'ta sovutilgan suv ikkita xarakterli haroratga ega t h = -36 ° C va t g = -140 ° C. 0°S > t > t h harorat oralig'ida yaxshi tozalangan va gazsizlangan suv uzoq vaqt davomida o'ta sovutilgan suyuqlik holatida qolishi mumkin. t g da< t < t h происходит гомогенное зарождение кристалликов льда, и вода не может находиться в переохлажденном состоянии при любой степени очистки. В условиях достаточно быстрого охлаждения при t < tg подвижность молекул воды настолько падает (а вязкость растет), что она образует стеклообразное твердое тело с аморфной структурой, свойственной жидкостям. При этом в области невысоких давлений образуется аморфная фаза низкой плотности, а в области повышенных – аморфная фаза высокой плотности, то есть вода демонстрирует полиаморфизм. При изменениях давления или температуры одна аморфная фаза скачком переходит в другую с неожиданно большим изменением плотности (>20%).
Suv poliamorfizmining tabiati bo'yicha bir nechta fikrlar mavjud. Shunday qilib, ga ko'ra, kuchli o'ta sovutilgan suvning bu xatti-harakati, agar ikkita H2O molekulalarining o'zaro ta'sirining potentsial profilida birdan ortiq minimal mavjudligini qabul qilsak, tushuntirilishi mumkin,

Guruch. 5(Tomonidan). Gipotetik potentsial profillar: a - bitta energiya minimal (masalan, Lennard-Jons potentsiali U(r) = A/r 6 - B/r 12) va b - ikkita barqaror konfiguratsiyaga mos keladigan ikkita energiya minimal bilan. r H va r L molekulalarining shartli markazlari orasidagi masofalar turlicha bo'lgan ikkita o'zaro ta'sir qiluvchi molekulalar suv (1 va 2) klasteri; ularning birinchisi yuqori zichlikdagi fazaga to'g'ri keladi, ikkinchisi - pastroq
va ikkita (5-rasm). Keyin yuqori zichlikdagi amorf faza o'rtacha masofa rH ga, past zichlikdagi faza esa rL ga to'g'ri keladi. Kompyuter modellashtirish bu nuqtai nazarni tasdiqlaydi, ammo bu gipoteza uchun ishonchli eksperimental dalillar hali ham mavjud emas, shuningdek, o'ta sovutilgan suvning bunday noodatiy xususiyatlarini tavsiflash uchun ikki quduq potentsialidan foydalanishning haqiqiyligini tasdiqlovchi qat'iy nazariya mavjud emas.
Haddan tashqari sovutilgan suvning xatti-harakati turli sabablarga ko'ra katta qiziqish uyg'otadi. Xususan, mamlakatimiz uchun dolzarb bo‘lgan iqlim sharoiti, yuqori kengliklarda navigatsiya qilish imkoniyati va rejimini belgilaydi. Interfeysda dinamik kristallanish jarayonida ko'plab qiziqarli va hali ham yaxshi tushunilmagan hodisalar, masalan, keng chastota diapazonida elektromagnit nurlanish bilan birga bo'lgan aralashmalarning qayta taqsimlanishi, elektr zaryadlarining ajralishi va keyinchalik bo'shashishi va boshqalar sodir bo'ladi. Nihoyat, kristallanish yuqori darajada sovutilgan suyuqlik juda yaxshi, ko'p marta takrorlanishi mumkin bo'lgan termodinamik muvozanatdan uzoqda bo'lgan va beqarorlikning rivojlanishi natijasida turli xil tartib va o'lchamdagi dendritlarni shakllantirishga qodir bo'lgan tizim xatti-harakatlarining namunaviy holati ( tipik vakillari - qor parchalari va derazalardagi muz naqshlari), fraktallarning xatti-harakatlarini yaratish va modellashtirish uchun qulay.
Bir qarashda, muzning erishi jarayonlarini kristallanish jarayonlariga qaraganda tahlil qilish osonroq ko'rinadi. Biroq, ular ham ko'p savollarni qoldiradilar. Masalan, erigan suv ma'lum vaqt davomida oddiy suvning xususiyatlaridan, hech bo'lmaganda biologik ob'ektlarga: o'simliklar, hayvonlar, odamlarga nisbatan farq qiladigan xususiyatlarga ega ekanligiga keng ishoniladi. Ehtimol, bu xususiyatlar yuqori kimyoviy tozalik (muz kristallanishi paytida nopoklikni ushlab turishning past koeffitsienti tufayli), erigan gazlar va ionlar tarkibidagi farqlar, shuningdek, muz tuzilishini suyuqlikning ko'p molekulyar klasterlarida saqlash bilan bog'liq bo'lishi mumkin. bosqichi. Biroq, muallif bu haqda zamonaviy fizik usullar bilan olingan ishonchli ma'lumotga ega emas.
Tashqi jismoniy maydonlarning, xususan, magnit maydonlarning suv, muz va fazaviy o'tish jarayonlari va xususiyatlariga ta'sir qilish mexanizmlarini tahlil qilish ham qiyin emas. Bizning butun hayotimiz Yer magnit maydonining doimiy ta'siri va uning zaif tebranishlari sharoitida sodir bo'ladi. Magnetobiologiya va tibbiyotda magnit bilan davolash usullari ko'p asrlar davomida rivojlanib kelmoqda. Nihoyat, agregatlar ommaviy ishlab chiqariladi va qishloq xo'jaligida sug'orishda (hosildorlikni oshirish uchun), bug 'qozonlarini quvvatlantirishda (ulardagi shkala hosil bo'lish tezligini kamaytirish uchun) va hokazolarda ishlatiladigan suvni magnitlash uchun keng qo'llaniladi. Biroq, bu va boshqa shunga o'xshash holatlarda magnit maydonning ta'sir qilish mexanizmlarining qoniqarli jismoniy tavsifi hali ham mavjud emas.
Xulosa
Suv, muz va ularning o'zaro fazali o'zgarishlari hali ham ko'plab sirlarga to'la. Ularni hal qilish nafaqat juda qiziq jismoniy muammo, balki Yerdagi hayot uchun ham nihoyatda muhim, chunki u inson salomatligi va farovonligi bilan bevosita bog'liq. Ehtimol, ular moddaning eng oddiy va taniqli kimyoviy tarkibining fizik xususiyatlarini shakllantirishda elektron va molekulyar tuzilish rolining eng yorqin misollaridan birini beradi.
Adabiyot:
1. Bogorodskiy V.V., Gavrilo V.P. Muz. L.: Gidrometeoizdat, 1980. 384 b.
2. Maeno N. Muz haqidagi fan. M.: Mir, 1988. 231 b.
3. Xobbs P.V. Muz fizikasi. Oksford: Universitet. Matbuot, 1974. 864 b.
4. Zatsepina G.N. Suvning fizik xossalari va tuzilishi. M.: Moskva davlat universiteti nashriyoti, 1998. 184 b.
5. Mishima O., Stenli E. Suyuq, o'ta sovutilgan va shisha suv o'rtasidagi munosabat // Tabiat. 1998. jild. 396. 329–335-betlar.
6. Zolotuxin I.V. Qattiq jism fizikasidagi fraktallar // Soros Educational Journal. 1998. No 7. 108–113-betlar. Maqolaning sharhlovchisi B.A. Strukov
Yuriy Ivanovich Golovin, fizika-matematika fanlari doktori, professor, rahbar. Tambov davlat universitetining nazariy va eksperimental fizika kafedrasi. GR. Derjavin, Rossiya Federatsiyasida xizmat ko'rsatgan fan arbobi. Ilmiy qiziqish doirasi qattiq jismlardagi nuqsonlarning elektron tuzilishi va ular keltirib chiqaradigan makroskopik xususiyatlardir. 200 dan ortiq ilmiy ishlar, shu jumladan monografiya va 40 ixtiro muallifi va hammuallifi.
Muz- kimyoviy bilan mineral H 2 O formulasi kristall holatda suvni ifodalaydi.
Muzning kimyoviy tarkibi: H - 11,2%, O - 88,8%. Ba'zan u gazsimon va qattiq mexanik aralashmalarni o'z ichiga oladi.
Tabiatda muz asosan 0 dan 80 ° C gacha bo'lgan harorat oralig'ida barqaror, erish nuqtasi 0 ° C bo'lgan bir nechta kristalli modifikatsiyalardan biri bilan ifodalanadi. Muz va amorf muzning 10 ta kristalli modifikatsiyalari ma'lum. Eng ko'p o'rganilgani 1-modifikatsiyadagi muz - tabiatda topilgan yagona modifikatsiya. Muz tabiatda muzning o'zi (kontinental, suzuvchi, er osti va boshqalar) shaklida, shuningdek, qor, ayoz va boshqalar shaklida uchraydi.
Shuningdek qarang:
TUZILISHI
Muzning kristall tuzilishi strukturaga o'xshaydi: har bir H 2 0 molekulasi o'ziga eng yaqin bo'lgan to'rtta molekula bilan o'ralgan, undan teng masofada joylashgan, 2,76b ga teng va muntazam tetraedrning uchlarida joylashgan. Koordinatsion raqamning pastligi tufayli muz tuzilishi ochiq ish bo'lib, uning zichligiga ta'sir qiladi (0,917). Muz olti burchakli fazoviy panjaraga ega va suvning 0 ° C va atmosfera bosimida muzlashi natijasida hosil bo'ladi. Muzning barcha kristalli modifikatsiyalarining panjarasi tetraedral tuzilishga ega. Muz birligi xujayrasining parametrlari (t 0°C da): a=0,45446 nm, c=0,73670 nm (c - qo'shni asosiy tekisliklar orasidagi masofa ikki barobar). Harorat tushganda, ular juda oz o'zgaradi. Muz panjarasidagi H 2 0 molekulalari bir-biri bilan vodorod bog'lari orqali bog'langan. Muz panjarasidagi vodorod atomlarining harakatchanligi kislorod atomlarining harakatchanligidan ancha yuqori, buning natijasida molekulalar qo'shnilarini o'zgartiradi. Muz panjarasida molekulalarning sezilarli tebranish va aylanish harakatlari mavjud bo'lganda, molekulalarning fazoviy bog'lanish joyidan translyatsion sakrashlari sodir bo'lib, keyingi tartibni buzadi va dislokatsiyalarni hosil qiladi. Bu muzning qaytarilmas deformatsiyalari (oqimi) va ularni keltirib chiqaradigan kuchlanishlar (plastiklik, yopishqoqlik, oquvchanlik, o'rmalanish va boshqalar) o'rtasidagi bog'liqlikni tavsiflovchi muzdagi o'ziga xos reologik xususiyatlarning namoyon bo'lishini tushuntiradi. Ushbu holatlar tufayli muzliklar yuqori yopishqoq suyuqliklarga o'xshash tarzda oqadi va shuning uchun tabiiy muz Yerdagi suv aylanishida faol ishtirok etadi. Muz kristallari nisbatan katta hajmga ega (ko'ndalang o'lcham millimetrning fraktsiyalaridan bir necha o'n santimetrgacha). Ular yopishqoqlik koeffitsientining anizotropiyasi bilan tavsiflanadi, ularning qiymati bir necha kattalik tartibida o'zgarishi mumkin. Kristallar yuklarning ta'siri ostida yo'nalishini o'zgartirishga qodir, bu ularning metamorfizatsiyasiga va muzliklarning oqim tezligiga ta'sir qiladi.
XUSUSIYATLARI

Muz rangsiz. Katta klasterlarda u mavimsi tus oladi. Shisha porlashi. Shaffof. Yig'ilish yo'q. Qattiqlik 1,5. Mo'rt. Optik jihatdan ijobiy, sinishi indeksi juda past (n = 1,310, nm = 1,309). Tabiatda muzning 14 ta modifikatsiyasi ma'lum. To'g'ri, olti burchakli tizimda kristallanadigan va I muz sifatida belgilangan tanish muzdan tashqari hamma narsa ekzotik sharoitlarda - juda past haroratlarda (taxminan -110150 0C) va yuqori bosimlarda, suvda vodorod bog'lanish burchaklari birlashganda hosil bo'ladi. molekula o'zgarishi va tizimlar hosil bo'ladi, olti burchaklidan farq qiladi. Bunday sharoitlar kosmosdagi sharoitlarga o'xshaydi va Yerda sodir bo'lmaydi. Masalan, -110 °C dan past haroratlarda suv bug'i oktaedr va bir necha nanometr o'lchamdagi kublar shaklida metall plastinkada cho'kadi - bu kub muz deb ataladi. Agar harorat -110 °C dan biroz yuqori bo'lsa va bug 'kontsentratsiyasi juda past bo'lsa, plastinkada juda zich amorf muz qatlami hosil bo'ladi.
MORFOLOGIYA

Muz tabiatda juda keng tarqalgan mineraldir. Yer qobig'ida bir necha turdagi muzlar mavjud: daryo, ko'l, dengiz, quruqlik, firn va muzlik. Ko'pincha u nozik kristalli donalarning agregat klasterlarini hosil qiladi. Sublimatsiya natijasida, ya'ni to'g'ridan-to'g'ri bug 'holatidan paydo bo'ladigan kristalli muz shakllanishi ham ma'lum. Bunday hollarda muz skelet kristallari (qor parchalari) va skelet va dendritik o'sish agregatlari (g'or muzi, muzli muz, muzlik va shishadagi naqshlar) ko'rinishida namoyon bo'ladi. Katta yaxshi kesilgan kristallar topiladi, lekin juda kam. N. N. Stulov Rossiyaning shimoli-sharqidagi muz kristallarini tasvirlab berdi, ular yer yuzasidan 55-60 m chuqurlikda topilgan, izometrik va ustunli ko'rinishga ega va eng katta kristalning uzunligi 60 sm, poydevorining diametri esa 15 sm.Muz kristallaridagi oddiy shakllardan faqat olti burchakli prizma (1120), olti burchakli bipiramida (1121) va pinakoid (0001) yuzlari aniqlangan.
Muz stalaktitlari, so'zma-so'z "aysiklar" deb ataladi, hamma uchun tanish. Kuz-qish fasllarida taxminan 0° harorat farqi bilan ular oqib turgan va tomayotgan suvning sekin muzlashi (kristallanishi) bilan Yer yuzasida hamma joyda oʻsadi. Ular muzli g'orlarda ham keng tarqalgan.
Muz qirg'oqlari - bu suv havzalari chegarasida suv havzalari va ko'lmaklarning chetlari, daryolar, ko'llar, ko'llar, suv omborlari va boshqalar bilan chegaradosh muzdan yasalgan muz qoplami. suv bo'shlig'ining qolgan qismi muzlamasligi bilan. Ular butunlay birga o'sganda, suv ombori yuzasida doimiy muz qoplami hosil bo'ladi.
Muz ham g'ovak tuproqlarda tolali tomirlar ko'rinishida parallel ustunli agregatlarni, ularning yuzasida esa muz antolitlarini hosil qiladi.
ASLI

Muz asosan suv havzalarida havo harorati pasayganda hosil bo'ladi. Shu bilan birga, suv yuzasida muz ignalaridan tashkil topgan muz pyuresi paydo bo'ladi. Pastdan uning ustida uzun muz kristallari o'sadi, ularning oltinchi tartibli simmetriya o'qlari qobiq yuzasiga perpendikulyar joylashgan. Turli shakllanish sharoitlarida muz kristallari o'rtasidagi munosabatlar rasmda ko'rsatilgan. Muz namlik bo'lgan va harorat 0 ° C dan past bo'lgan hamma joyda keng tarqalgan. Ba'zi joylarda er muzlari faqat sayoz chuqurlikka erishadi, undan pastda esa abadiy muzlik boshlanadi. Bular permafrost deb ataladigan hududlardir; Er qobig'ining yuqori qatlamlarida abadiy muzlik tarqalgan hududlarda er osti muzlari topiladi, ular orasida zamonaviy va qazilma er osti muzlari ajralib turadi. Yerning umumiy quruqlik maydonining kamida 10% muzliklar bilan qoplangan; ularni tashkil etuvchi monolit muz jinsi muzlik muzlari deb ataladi. Muzlik muzi, birinchi navbatda, qorning siqilishi va o'zgarishi natijasida to'planishidan hosil bo'ladi. Muz qatlami Grenlandiyaning taxminan 75% ni va Antarktidaning deyarli barchasini qoplaydi; muzliklarning eng katta qalinligi (4330 m) Berd stantsiyasi (Antarktida) yaqinida joylashgan. Grenlandiyaning markaziy qismida muzning qalinligi 3200 m ga etadi.
Muz konlari yaxshi ma'lum. Sovuq, qishi uzoq va yozi qisqa bo'lgan joylarda, shuningdek, baland tog'li hududlarda stalaktit va stalagmitli muz g'orlari hosil bo'ladi, ular orasida eng qiziqarlilari Uralning Perm viloyatidagi Kungurskaya, shuningdek, Dobshine g'oridir. Slovakiya.
Dengiz suvi muzlaganda dengiz muzi hosil bo'ladi. Dengiz muzining xarakterli xususiyatlari sho'rligi va g'ovakligi bo'lib, uning zichligi 0,85 dan 0,94 g / sm 3 gacha bo'lgan diapazonni aniqlaydi. Bunday past zichlik tufayli muz qatlamlari suv yuzasidan qalinligining 1/7-1/10 qismiga ko'tariladi. Dengiz muzlari -2,3 ° C dan yuqori haroratlarda eriy boshlaydi; chuchuk suv muziga qaraganda elastikroq va bo'laklarga bo'linish qiyinroq.
ILOVA

1980-yillarning oxirida Argonna laboratoriyasi muz yig'indilarida to'planmasdan, bir-biriga yopishmasdan yoki sovutish tizimlarini yopib qo'ymasdan, turli diametrli quvurlar orqali erkin oqishi mumkin bo'lgan muz shlamini tayyorlash texnologiyasini ishlab chiqdi. Tuzli suv suspenziyasi juda kichik dumaloq shakldagi muz kristallaridan iborat edi. Buning yordamida suvning harakatchanligi saqlanib qoladi va shu bilan birga, issiqlik texnikasi nuqtai nazaridan u muzni ifodalaydi, bu binolarning sovutish tizimlarida oddiy sovuq suvdan 5-7 baravar samaraliroqdir. Bundan tashqari, bunday aralashmalar tibbiyot uchun istiqbolli. Hayvonlar ustida o'tkazilgan tajribalar shuni ko'rsatdiki, muz aralashmasining mikrokristallari juda kichik qon tomirlariga mukammal tarzda o'tadi va hujayralarga zarar etkazmaydi. "Muzli qon" qurbonni qutqarish vaqtini uzaytiradi. Aytaylik, yurak ushlangan taqdirda, konservativ hisob-kitoblarga ko'ra, bu vaqt 10-15 dan 30-45 minutgacha uzaytiriladi.
Muzdan konstruktiv material sifatida foydalanish qutbli hududlarda turar-joylar - iglooslarni qurish uchun keng tarqalgan. Muz D.Pike tomonidan taklif qilingan Pikerit materialining bir qismi bo'lib, undan dunyodagi eng katta samolyot tashuvchisini yaratish taklif qilingan.
Muz - H 2 O
TASNIFI
| Strunz (8-nashr) | 4/A.01-10 |
| Nikel-Strunz (10-nashr) | 4.AA.05 |
| Dana (8-nashr) | 4.1.2.1 |
| Hey's CIM Ref. | 7.1.1 |