Struktura e ujit. Vetitë e ujit Dallimet kryesore midis akullit dhe ujit në nivel molekular
Nga 14 format e njohura aktualisht të ujit të ngurtë në natyrë, gjejmë vetëm një - akull. Pjesa tjetër janë formuar në kushte ekstreme dhe janë të paarritshme për vëzhgime jashtë laboratorëve specialë. Vetia më intriguese e akullit është shumëllojshmëria e mahnitshme e manifestimeve të jashtme. Me të njëjtën strukturë kristalore, mund të duket krejtësisht ndryshe, duke marrë formën e gurëve të breshërit dhe akullit transparent, thekoneve të dëborës me gëzof, një kore të dendur me shkëlqim bredhi në një fushë dëbore ose masave gjigante akullnajore.
Në qytetin e vogël japonez të Kaga, i vendosur në bregun perëndimor të ishullit Honshu, ekziston një muze i pazakontë. Borë dhe akull. Ajo u themelua nga Ukihiro Nakaya, personi i parë që mësoi të rritë flokë bore artificiale në laborator, aq të bukura sa ato që bien nga qielli. Në këtë muze, vizitorët janë të rrethuar nga të gjitha anët me gjashtëkëndësha të rregullt, sepse është pikërisht kjo simetri "gjashtëkëndore" që është karakteristike për kristalet e zakonshme të akullit (meqë ra fjala, fjala greke kristallos në të vërtetë do të thotë "akull"). Ai përcakton shumë nga vetitë e tij unike dhe bën që floket e borës, me gjithë shumëllojshmërinë e tyre të pafund, të rriten në formën e yjeve me gjashtë, më rrallë tre ose dymbëdhjetë rreze, por kurrë me katër ose pesë.
Molekulat në punë të hapur
Çelësi i strukturës së ujit të ngurtë qëndron në strukturën e molekulës së tij. H2O mund të përfaqësohet në mënyrë të thjeshtë si një katërkëndor (një piramidë me një bazë trekëndore). Në qendër ka oksigjen, në dy kulme është një hidrogjen, më saktë një proton, elektronet e të cilit janë të përfshirë në formimin e një lidhje kovalente me oksigjenin. Dy kulmet e mbetura janë të zëna nga çifte elektronesh të valencës së oksigjenit, të cilat nuk marrin pjesë në formimin e lidhjeve intramolekulare, prandaj quhen të vetmuar.
Kur një proton i një molekule ndërvepron me një palë elektrone të vetme oksigjeni të një molekule tjetër, formohet një lidhje hidrogjeni, më pak e fortë se një lidhje intramolekulare, por mjaft e fuqishme për të mbajtur së bashku molekulat fqinje. Çdo molekulë mund të krijojë njëkohësisht katër lidhje hidrogjeni me molekula të tjera në kënde të përcaktuara rreptësisht, të cilat nuk lejojnë krijimin e një strukture të dendur kur ngrihet. Kjo kornizë e padukshme e lidhjeve hidrogjenore i rregullon molekulat në një rrjet dantelle me kanale të zbrazëta. Sapo akulli nxehet, dantella shembet: molekulat e ujit fillojnë të bien në zbrazëtirat e rrjetës, duke çuar në një strukturë më të dendur të lëngut, kjo është arsyeja pse uji është më i rëndë se akulli.Akulli, i cili formohet në presionin atmosferik dhe shkrihet në 0°C, është substanca më e zakonshme, por ende e pa kuptuar plotësisht. Pjesa më e madhe në strukturën dhe vetitë e saj duket e pazakontë. Në vendet e rrjetës kristalore të akullit, atomet e oksigjenit janë rregulluar në mënyrë të rregullt, duke formuar gjashtëkëndësha të rregullt, por atomet e hidrogjenit zënë një sërë pozicionesh përgjatë lidhjeve. Kjo sjellje e atomeve është përgjithësisht atipike - si rregull, në një substancë të ngurtë të gjithë i binden të njëjtit ligj: ose të gjithë atomet janë të rregulluar në mënyrë të rregullt, dhe pastaj është një kristal, ose rastësisht, dhe më pas është një substancë amorfe.
Akulli është i vështirë të shkrihet, sado e çuditshme që mund të tingëllojë. Nëse nuk do të kishte lidhje hidrogjeni që mbanin së bashku molekulat e ujit, ai do të shkrihej në 90°C. Në të njëjtën kohë, kur uji ngrin, ai nuk zvogëlohet në vëllim, siç ndodh me shumicën e substancave të njohura, por rritet për shkak të formimit të një strukture të hapur akulli."Çuditë" e akullit përfshijnë gjithashtu gjenerimin e rrezatimit elektromagnetik nga kristalet e tij në rritje. Dihet prej kohësh se shumica e papastërtive të tretura në ujë nuk transferohen në akull kur ai fillon të rritet; me fjalë të tjera, ai ngrin. Prandaj, edhe në pellgun më të ndotur, filmi i akullit është i pastër dhe transparent. Papastërtitë grumbullohen në ndërfaqen ndërmjet mediave të ngurta dhe të lëngëta, në formën e dy shtresave të ngarkesave elektrike me shenja të ndryshme, të cilat shkaktojnë një ndryshim të rëndësishëm potencial. Shtresa e ngarkuar e papastërtive lëviz së bashku me kufirin e poshtëm të akullit të ri dhe lëshon valë elektromagnetike. Falë kësaj, procesi i kristalizimit mund të vëzhgohet në detaje. Kështu, një kristal që rritet në gjatësi në formën e një gjilpëre lëshon ndryshe nga ai i mbuluar me procese anësore, dhe rrezatimi i kokrrave në rritje ndryshon nga ai që ndodh kur kristalet plasariten. Nga forma, sekuenca, frekuenca dhe amplituda e pulseve të rrezatimit, mund të përcaktohet se me çfarë shpejtësie ngrin akulli dhe çfarë lloj strukture akulli është marrë.
Akull i gabuar
Në gjendje të ngurtë, uji ka, sipas të dhënave të fundit, 14 modifikime strukturore. Disa prej tyre janë kristalore (shumica e tyre), disa janë amorfe, por të gjithë ndryshojnë nga njëri-tjetri në rregullimin relativ të molekulave dhe vetive të ujit. Vërtetë, gjithçka përveç akullit me të cilin jemi njohur, formohet në kushte ekzotike - në temperatura shumë të ulëta dhe presione të larta, kur këndet e lidhjeve të hidrogjenit në molekulën e ujit ndryshojnë dhe formohen sisteme të tjera përveç gjashtëkëndore. Për shembull, në temperaturat nën 110°C, avulli i ujit precipiton në një pllakë metalike në formën e oktaedrave dhe kube disa nanometra në madhësi - ky është i ashtuquajturi akull kub. Nëse temperatura është pak mbi 110° dhe përqendrimi i avullit është shumë i ulët, një shtresë akulli amorf jashtëzakonisht i dendur formohet në pjatë.
Dy modifikimet e fundit të akullit XIII dhe XIV u zbuluan nga shkencëtarët nga Oksfordi kohët e fundit, në vitin 2006. Parashikimi 40-vjeçar se kristalet e akullit me rrjeta monoklinike dhe rombike duhet të ekzistojnë ishte i vështirë për t'u konfirmuar: viskoziteti i ujit në një temperaturë prej 160 ° C është shumë i lartë dhe molekulat e ujit ultra të pastër të superftohur bashkohen në sasi të tilla. për të formuar një bërthamë kristal, e vështirë. Katalizatori ndihmoi: acidi klorhidrik, i cili rriti lëvizshmërinë e molekulave të ujit në temperatura të ulëta. Modifikime të tilla të akullit nuk mund të formohen në natyrën tokësore, por ato mund të kërkohen në satelitët e ngrirë të planetëve të tjerë.
Kështu vendosi komisioniNjë flok bore është një kristal i vetëm akulli, një variacion në temën e një kristali gjashtëkëndor, por që u rrit shpejt në kushte jo ekuilibri. Mendjet më kureshtare kanë luftuar me sekretin e bukurisë së tyre dhe diversitetit të pafund për shekuj. Astronomi Johannes Kepler shkroi një traktat të tërë "Për flokë dëbore gjashtëkëndore" në 1611. Në vitin 1665, Robert Hooke, në një vëllim të madh skicash të gjithçkaje që pa me mikroskop, botoi shumë vizatime të borës me forma të ndryshme. Fotografia e parë e suksesshme e një flok bore nën një mikroskop u bë në 1885 nga fermeri amerikan Wilson Bentley. Që atëherë ai nuk mund të ndalej. Deri në fund të jetës së tij, për më shumë se dyzet vjet, Bentley i fotografoi ata. Më shumë se pesë mijë kristale, dhe asnjë i vetëm nuk është i njëjtë.
Ndjekësit më të famshëm të kauzës së Bentley-t janë Ukihiro Nakaya i përmendur tashmë dhe fizikani amerikan Kenneth Libbrecht. Nakaya ishte i pari që sugjeroi se madhësia dhe forma e flokeve të borës varen nga temperatura e ajrit dhe përmbajtja e lagështisë, dhe e konfirmoi shkëlqyeshëm këtë hipotezë eksperimentalisht duke rritur kristale akulli të formave të ndryshme në laborator. Dhe Libbrecht madje filloi të rritë flokë dëbore të bëra me porosi të një forme të paracaktuar.
Jeta e një flok dëbore fillon me formimin e bërthamave kristalore të akullit në një re avulli uji ndërsa temperatura bie. Qendra e kristalizimit mund të jenë grimcat e pluhurit, çdo grimcë e ngurtë apo edhe jone, por në çdo rast, këto copa akulli më pak se një e dhjeta e milimetrit në madhësi tashmë kanë një rrjetë kristalore gjashtëkëndore.
Avujt e ujit, duke u kondensuar në sipërfaqen e këtyre bërthamave, së pari formon një prizëm të vogël gjashtëkëndor, nga gjashtë qoshet e të cilit fillojnë të rriten gjilpëra akulli plotësisht identike dhe procese anësore. Ato janë të njëjta thjesht sepse temperatura dhe lagështia rreth embrionit janë gjithashtu të njëjta. Mbi to, nga ana tjetër, rriten fidanet dhe degët anësore, si në një pemë. Kristale të tilla quhen dendrite, domethënë të ngjashme me drurin.
Duke lëvizur lart e poshtë në një re, një flok dëbore ndeshet me kushte me temperatura dhe përqendrime të ndryshme të avullit të ujit. Forma e saj ndryshon, duke iu bindur deri në fund ligjeve të simetrisë gjashtëkëndore. Kështu ndryshojnë floket e borës. Edhe pse teorikisht, në të njëjtën re në të njëjtën lartësi, ato mund të "dalin" identike. Por secila ka rrugën e vet për në tokë, e cila është mjaft e gjatë; mesatarisht, një flok dëbore bie me një shpejtësi prej 0.9 km në orë. Kjo do të thotë se secili ka historinë e vet dhe formën e tij përfundimtare. Akulli që formon një fjollë dëbore është transparent, por kur ka shumë prej tyre, drita e diellit, e reflektuar dhe e shpërndarë në fytyra të shumta, na jep përshtypjen e një mase të bardhë të errët - ne e quajmë atë borë.
Për të shmangur konfuzionin me shumëllojshmërinë e flokeve të dëborës, Komisioni Ndërkombëtar për Borën dhe Akullin miratoi në vitin 1951 një klasifikim mjaft të thjeshtë të kristaleve të akullit: pllaka, kristale yjesh, kolona ose kolona, hala, dendritet hapësinore, kolona me majë dhe forma të parregullta. Dhe tre lloje të tjera të reshjeve të akullta: fishekët e imët të borës, fishekët e akullit dhe breshër.Rritja e ngricave, ngricave dhe modeleve në xhami i nënshtrohet të njëjtave ligje. Këto dukuri, si floket e borës, formohen nga kondensimi, molekulë për molekulë, në tokë, bar, pemë. Modelet në dritare shfaqen në mot të ftohtë, kur lagështia nga ajri i ngrohtë i dhomës kondensohet në sipërfaqen e xhamit. Por gurët e breshërit formohen kur pikat e ujit ngrijnë ose kur akulli në retë e ngopura me avujt e ujit ngrin në shtresa të dendura mbi embrionet e flokeve të borës. Flokë dëbore të tjera, tashmë të formuara, mund të ngrijnë mbi gurët e breshërit, duke u shkrirë me to, për shkak të të cilave gurët e breshërit marrin format më të çuditshme.
Për ne në Tokë, mjafton një modifikim i ngurtë i ujit - akulli i zakonshëm. Ai përshkon fjalë për fjalë të gjitha zonat e banimit ose qëndrimit njerëzor. Duke u mbledhur në sasi të mëdha, bora dhe akulli formojnë struktura të veçanta me veti që janë thelbësisht të ndryshme nga ato të kristaleve individuale ose flokeve të borës. Akullnajat malore, mbulesat e akullit të zonave ujore, ngrica e përhershme dhe thjesht mbulimi i borës sezonale ndikojnë ndjeshëm në klimën e rajoneve të mëdha dhe planetit në tërësi: edhe ata që nuk e kanë parë kurrë borën e ndjejnë frymën e masave të saj të grumbulluara në polet e Tokës, sepse shembull, në formën e luhatjeve afatgjata në nivelin e Oqeanit Botëror. Dhe akulli është aq i rëndësishëm për pamjen e planetit tonë dhe habitatin e rehatshëm të krijesave të gjalla në të, sa shkencëtarët kanë caktuar një mjedis të veçantë për të - kriosferën, e cila shtrin domenin e saj lart në atmosferë dhe thellë në koren e tokës.
Olga Maksimenko, kandidate e Shkencave Kimike
Kërkim i personalizuar
Struktura e ujit
Ph.D. O.V. Mosin
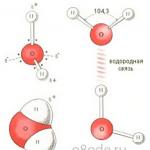
Një molekulë uji është një dipol i vogël që përmban ngarkesa pozitive dhe negative në polet e saj. Meqenëse masa dhe ngarkesa e bërthamës së oksigjenit është më e madhe se ajo e bërthamave të hidrogjenit, reja e elektroneve tërhiqet drejt bërthamës së oksigjenit. Në këtë rast, bërthamat e hidrogjenit ekspozohen. Kështu, reja e elektroneve ka një dendësi jo uniforme. Ka mungesë të densitetit të elektroneve pranë bërthamave të hidrogjenit, dhe në anën e kundërt të molekulës, pranë bërthamës së oksigjenit, ka një tepricë të densitetit të elektroneve. Është kjo strukturë që përcakton polaritetin e molekulës së ujit. Nëse lidhni epiqendrat e ngarkesave pozitive dhe negative me vija të drejta, ju merrni një figurë gjeometrike tredimensionale - një tetraedron të rregullt.
 Struktura e një molekule uji (foto në të djathtë)
Struktura e një molekule uji (foto në të djathtë)
Për shkak të pranisë së lidhjeve hidrogjenore, çdo molekulë uji formon një lidhje hidrogjeni me 4 molekula fqinje, duke formuar një kornizë rrjetë të hapur në molekulën e akullit. Megjithatë, në gjendje të lëngshme, uji është një lëng i çrregullt; Këto lidhje hidrogjenore janë spontane, jetëshkurtra, shpejt thyhen dhe formohen përsëri. E gjithë kjo çon në heterogjenitet në strukturën e ujit.
 Lidhjet e hidrogjenit midis molekulave të ujit (foto poshtë majtas)
Lidhjet e hidrogjenit midis molekulave të ujit (foto poshtë majtas)
Fakti që uji është heterogjen në përbërje është vërtetuar shumë kohë më parë. Dihet prej kohësh se akulli noton në sipërfaqen e ujit, domethënë, dendësia e akullit kristalor është më e vogël se dendësia e lëngut.
Për pothuajse të gjitha substancat e tjera, kristali është më i dendur se faza e lëngshme. Përveç kësaj, edhe pas shkrirjes, me rritjen e temperaturës, dendësia e ujit vazhdon të rritet dhe arrin maksimumin në 4C. Më pak e njohur është anomalia e ngjeshshmërisë së ujit: kur nxehet nga pika e shkrirjes deri në 40C, zvogëlohet dhe më pas rritet. Kapaciteti i nxehtësisë së ujit varet gjithashtu në mënyrë jo monotonike nga temperatura.
Përveç kësaj, në temperaturat nën 30C, me një rritje të presionit nga atmosferik në 0,2 GPa, viskoziteti i ujit zvogëlohet dhe rritet koeficienti i vetëdifuzionit, një parametër që përcakton shpejtësinë e lëvizjes së molekulave të ujit në raport me njëra-tjetrën.
Për lëngjet e tjera marrëdhënia është e kundërta dhe pothuajse askund nuk ndodh që ndonjë parametër i rëndësishëm të sillet në mënyrë jo monotone, d.m.th. fillimisht u rrit, dhe pas kalimit një vlerë kritike e temperaturës ose presionit u ul. U ngrit një supozim se në fakt uji nuk është një lëng i vetëm, por një përzierje e dy përbërësve që ndryshojnë në vetitë, për shembull, densiteti dhe viskoziteti, dhe për këtë arsye struktura. Ide të tilla filluan të lindin në fund të shekullit të 19-të, kur u grumbulluan shumë të dhëna për anomalitë e ujit.
Whiting ishte i pari që propozoi idenë se uji përbëhet nga dy përbërës në 1884. Autorësia e tij citohet nga E.F. Fritsman në monografinë "Natyra e ujit. Uji i rëndë", botuar në 1935. Në 1891, V. Rengten prezantoi konceptin e dy gjendjeve të ujit, të cilat ndryshojnë në densitet. Pas saj, u shfaqën shumë vepra në të cilat uji konsiderohej si një përzierje e bashkëpunëtorëve të përbërjeve të ndryshme (hidrole).
Kur struktura e akullit u përcaktua në vitet 1920, rezultoi se molekulat e ujit në gjendje kristalore formojnë një rrjet të vazhdueshëm tre-dimensional në të cilin secila molekulë ka katër fqinjët më të afërt të vendosur në kulmet e një tetraedri të rregullt. Në vitin 1933, J. Bernal dhe P. Fowler sugjeruan që një rrjet i ngjashëm ekziston në ujin e lëngshëm. Meqenëse uji është më i dendur se akulli, ata besonin se molekulat në të nuk janë të rregulluara si në akull, domethënë, si atomet e silikonit në mineralin tridymite, por si atomet e silikonit në një modifikim më të dendur të silicës, kuarcit. Rritja e densitetit të ujit kur nxehet nga 0 në 4 C shpjegohej me praninë e komponentit tridimit në temperatura të ulëta. Kështu, modeli i Bernal Fowler ruajti elementin e dy strukturave, por arritja e tyre kryesore ishte ideja e një rrjeti të vazhdueshëm tetraedral. Pastaj u shfaq aforizmi i famshëm i I. Langmuir: "Oqeani është një molekulë e madhe". Specifikimi i tepërt i modelit nuk e rriti numrin e mbështetësve të teorisë së rrjetit të unifikuar.
Vetëm në vitin 1951 J. Pople krijoi një model rrjeti të vazhdueshëm, i cili nuk ishte aq specifik sa modeli i Bernal Fowler. Pople e imagjinoi ujin si një rrjet tetraedral të rastësishëm, lidhjet ndërmjet molekulave në të cilat janë të lakuara dhe kanë gjatësi të ndryshme. Modeli i Pople shpjegon ngjeshjen e ujit gjatë shkrirjes nga përkulja e lidhjeve. Kur u shfaqën përkufizimet e para të strukturës së akullit II dhe IX në vitet 60-70, u bë e qartë se si përkulja e lidhjeve mund të çojë në ngjeshjen e strukturës. Modeli i Pople nuk mund të shpjegonte varësinë jo monotonike të vetive të ujit nga temperatura dhe presioni, si dhe modelet me dy gjendje. Prandaj, ideja e dy shteteve u nda nga shumë shkencëtarë për një kohë të gjatë.
Por në gjysmën e dytë të shekullit të 20-të ishte e pamundur të fantazoje për përbërjen dhe strukturën e hidroleve siç bënin në fillim të shekullit. Dihej tashmë se si funksionojnë akulli dhe hidratet kristalore, dhe ata dinin shumë për lidhjet hidrogjenore. Krahas modeleve të vazhdimësisë (modeli i Poples), janë shfaqur dy grupe modelesh të përziera: grupimi dhe klatrati. Në grupin e parë, uji u shfaq në formën e grupimeve të molekulave të lidhura me lidhje hidrogjeni, të cilat notonin në një det molekulash që nuk përfshiheshin në lidhje të tilla. Grupi i dytë i modeleve e trajtonte ujin si një rrjet të vazhdueshëm (zakonisht i quajtur kornizë në këtë kontekst) lidhjesh hidrogjeni që përmbanin zbrazëtira; ato përmbajnë molekula që nuk krijojnë lidhje me molekulat e kornizës. Nuk ishte e vështirë të zgjidheshin vetitë dhe përqendrimet e dy mikrofazave të modeleve të grupimeve ose vetitë e kornizës dhe shkalla e mbushjes së boshllëqeve të saj të modeleve të klatratit për të shpjeguar të gjitha vetitë e ujit, përfshirë anomalitë e famshme.
Ndër modelet e claster-it, më i spikatur ishte modeli i G. Nemetit dhe H. Sheragi.: Fotot që ata propozuan, duke përshkruar grupe molekulash të lidhura që notojnë në një det molekulash të palidhura, u përfshinë në shumë monografi.
Modeli i parë i llojit clathrate u propozua në 1946 nga O.Ya Samoilov: në ujë, ruhet një rrjet lidhjesh hidrogjeni të ngjashme me akullin gjashtëkëndor, zgavrat e të cilave janë pjesërisht të mbushura me molekula monomere. L. Pauling në vitin 1959 krijoi një opsion tjetër, duke sugjeruar se baza e strukturës mund të ishte një rrjet lidhjesh të qenësishme në disa hidrate kristalore.
Gjatë gjysmës së dytë të viteve '60 dhe fillimit të viteve '70, u vu re një konvergjencë e të gjitha këtyre pikëpamjeve. U shfaqën variante të modeleve të grupimeve në të cilat molekulat në të dy mikrofazat lidhen me lidhje hidrogjeni. Përkrahësit e modeleve clathrate filluan të pranojnë formimin e lidhjeve hidrogjenore midis molekulave të zbrazëta dhe kornizës. Kjo është, në fakt, autorët e këtyre modeleve e konsiderojnë ujin si një rrjet të vazhdueshëm lidhjesh hidrogjeni. Dhe ne po flasim se sa heterogjen është ky rrjet (për shembull, në densitet). Ideja e ujit si grupime të lidhura me hidrogjenin që notojnë në një det me molekula të palidhura uji iu dha fund në fillim të viteve tetëdhjetë, kur G. Stanley aplikoi teorinë e perkolimit, e cila përshkruan kalimet fazore të ujit, në model uji.
Në vitin 1999, studiuesi i famshëm rus i ujit S.V. Zenin mbrojti disertacionin e doktoraturës në Institutin e Problemeve Mjekësore dhe Biologjike të Akademisë Ruse të Shkencave mbi teorinë e grupimeve, e cila ishte një hap i rëndësishëm në avancimin e kësaj fushe të kërkimit, kompleksiteti i së cilës rritet nga fakti se ata janë në kryqëzimin e tre shkencave: fizikës, kimisë dhe biologjisë. Bazuar në të dhënat e marra nga tre metoda fiziko-kimike: refraktometria (S.V. Zenin, B.V. Tyaglov, 1994), kromatografia e lëngshme me performancë të lartë (S.V. Zenin et al., 1998) dhe rezonanca magnetike protonike (C S.V. Zenin, 1993 e konstruktuar dhe e provuar) modeli i formimit strukturor kryesor të qëndrueshëm të molekulave të ujit (uji i strukturuar), dhe më pas (S.V. Zenin, 2004) u mor një imazh i këtyre strukturave duke përdorur një mikroskop me fazë kontrasti.
 Shkenca tani ka vërtetuar se veçoritë e vetive fizike të ujit dhe lidhjet e shumta të hidrogjenit jetëshkurtër midis atomeve fqinje të hidrogjenit dhe oksigjenit në një molekulë uji krijojnë mundësi të favorshme për formimin e strukturave të veçanta të lidhura (grupe) që perceptojnë, ruajnë dhe transmetojnë një shumëllojshmëri të gjerë informacioni.
Shkenca tani ka vërtetuar se veçoritë e vetive fizike të ujit dhe lidhjet e shumta të hidrogjenit jetëshkurtër midis atomeve fqinje të hidrogjenit dhe oksigjenit në një molekulë uji krijojnë mundësi të favorshme për formimin e strukturave të veçanta të lidhura (grupe) që perceptojnë, ruajnë dhe transmetojnë një shumëllojshmëri të gjerë informacioni.
Njësia strukturore e një uji të tillë është një grumbull i përbërë nga clathrates, natyra e të cilit përcaktohet nga forcat Kulomb me rreze të gjatë. Struktura e grupimeve kodon informacion në lidhje me ndërveprimet që ndodhën me këto molekula uji. Në grupimet e ujit, për shkak të ndërveprimit midis lidhjeve kovalente dhe hidrogjenit midis atomeve të oksigjenit dhe atomeve të hidrogjenit, migrimi i një protoni (H+) mund të ndodhë nëpërmjet një mekanizmi rele, duke çuar në delokalizimin e protonit brenda grupit.
Uji, i përbërë nga shumë grupime të llojeve të ndryshme, formon një strukturë kristalore të lëngët hapësinore hierarkike që mund të perceptojë dhe ruajë sasi të mëdha informacioni.
Figura (V.L. Voeikov) tregon diagramet e disa strukturave të thjeshta të grupimit si shembull.
Disa struktura të mundshme të grupimeve të ujit

Fushat fizike të natyrës shumë të ndryshme mund të jenë bartës të informacionit. Kështu, është krijuar mundësia e ndërveprimit të informacionit në distancë të strukturës kristalore të lëngshme të ujit me objekte të natyrave të ndryshme duke përdorur fusha elektromagnetike, akustike dhe fusha të tjera. Objekti ndikues mund të jetë edhe një person.
Uji është një burim i rrezatimit elektromagnetik të alternuar ultra të dobët dhe të dobët. Rrezatimi elektromagnetik më pak kaotik krijohet nga uji i strukturuar. Në këtë rast, mund të ndodhë induksioni i një fushe elektromagnetike përkatëse, duke ndryshuar karakteristikat strukturore dhe të informacionit të objekteve biologjike.
Vitet e fundit janë marrë të dhëna të rëndësishme për vetitë e ujit të superftohur. Studimi i ujit në temperatura të ulëta është shumë interesant, pasi mund të superftohet më shumë se lëngjet e tjera. Kristalizimi i ujit, si rregull, fillon në disa inhomogjenitete ose në muret e enës ose në grimcat lundruese të papastërtive të ngurta. Prandaj, nuk është e lehtë të gjesh temperaturën në të cilën uji i superftohur do të kristalizohej spontanisht. Por shkencëtarët arritën ta bëjnë këtë, dhe tani temperatura e të ashtuquajturit nukleacion homogjen, kur formimi i kristaleve të akullit ndodh njëkohësisht në të gjithë vëllimin, njihet për presione deri në 0.3 GPa, domethënë që mbulon rajonet e ekzistencës së akull II.
Nga presioni atmosferik në kufirin që ndan akullin I dhe II, kjo temperaturë zbret nga 231 në 180 K dhe më pas rritet pak në 190 K. Nën këtë temperaturë kritike, uji i lëngshëm është në parim i pamundur.
Struktura e akullit (foto në të djathtë)
 Megjithatë, ekziston një mister që lidhet me këtë temperaturë. Në mesin e viteve tetëdhjetë, u zbulua një modifikim i ri i akullit amorf - akulli me densitet të lartë, dhe kjo ndihmoi në ringjalljen e idesë së ujit si një përzierje e dy gjendjeve. Jo strukturat kristalore, por strukturat e akullit amorf me dendësi të ndryshme u konsideruan si prototipe. Ky koncept u formulua në formën më të qartë nga E.G. Ponyatovsky dhe V.V. Sinitsin, të cilët shkruan në vitin 1999: "Uji konsiderohet si një zgjidhje e rregullt e dy komponentëve, konfigurimet lokale në të cilat korrespondojnë me rendin me rreze të shkurtër të modifikimeve të akullit amorf. .” Për më tepër, duke studiuar rendin me rreze të shkurtër në ujin e superftohur me presion të lartë duke përdorur metodat e difraksionit të neutronit, shkencëtarët ishin në gjendje të gjenin komponentë që korrespondonin me këto struktura.
Megjithatë, ekziston një mister që lidhet me këtë temperaturë. Në mesin e viteve tetëdhjetë, u zbulua një modifikim i ri i akullit amorf - akulli me densitet të lartë, dhe kjo ndihmoi në ringjalljen e idesë së ujit si një përzierje e dy gjendjeve. Jo strukturat kristalore, por strukturat e akullit amorf me dendësi të ndryshme u konsideruan si prototipe. Ky koncept u formulua në formën më të qartë nga E.G. Ponyatovsky dhe V.V. Sinitsin, të cilët shkruan në vitin 1999: "Uji konsiderohet si një zgjidhje e rregullt e dy komponentëve, konfigurimet lokale në të cilat korrespondojnë me rendin me rreze të shkurtër të modifikimeve të akullit amorf. .” Për më tepër, duke studiuar rendin me rreze të shkurtër në ujin e superftohur me presion të lartë duke përdorur metodat e difraksionit të neutronit, shkencëtarët ishin në gjendje të gjenin komponentë që korrespondonin me këto struktura.
Një pasojë e polimorfizmit të akullit amorf ka çuar gjithashtu në supozime për ndarjen e ujit në dy përbërës të papërziershëm në temperatura nën pikën kritike hipotetike të temperaturës së ulët. Fatkeqësisht, sipas studiuesve, kjo temperaturë në një presion prej 0.017 GPa është 230 K nën temperaturën e bërthamës, kështu që askush nuk ka qenë ende në gjendje të vëzhgojë shtresimin e ujit të lëngshëm. Kështu, ringjallja e modelit me dy shtete ngriti çështjen e heterogjenitetit të rrjetit të lidhjeve hidrogjenore në ujin e lëngshëm. Ky heterogjenitet mund të kuptohet vetëm duke përdorur modelimin kompjuterik.
Duke folur për strukturën kristalore të ujit, duhet theksuar se njihen 14 modifikime të akullit. shumica e të cilave nuk gjenden në natyrë, në të cilën molekulat e ujit ruajnë individualitetin e tyre dhe lidhen me lidhje hidrogjenore. Nga ana tjetër, ka shumë variante të rrjetit të lidhjeve hidrogjenore në hidratet e klatratit. Energjitë e këtyre rrjeteve (akulli me presion të lartë dhe hidratet clathrate) nuk janë shumë më të larta se energjitë e akullit kub dhe gjashtëkëndor. Prandaj, fragmente të strukturave të tilla mund të shfaqen edhe në ujë të lëngshëm. Është e mundur të ndërtohen fragmente të panumërta të ndryshme jo periodike, molekulat e të cilave kanë katër fqinjët më të afërt të vendosur afërsisht në kulmet e tetraedrit, por struktura e tyre nuk korrespondon me strukturat e modifikimeve të njohura të akullit. Siç kanë treguar llogaritjet e shumta, energjitë e ndërveprimit të molekulave në fragmente të tilla do të jenë afër njëra-tjetrës dhe nuk ka asnjë arsye të thuhet se ndonjë strukturë duhet të mbizotërojë në ujin e lëngshëm.
Studimet strukturore të ujit mund të studiohen duke përdorur metoda të ndryshme; Spektroskopia e rezonancës magnetike protonike, spektroskopia infra të kuqe, difraksioni i rrezeve X, etj. Për shembull, difraksioni i rrezeve X dhe neutroneve është studiuar shumë herë. Megjithatë, këto eksperimente nuk mund të japin informacion të detajuar rreth strukturës. Inhomogjenitetet që ndryshojnë në densitet mund të shihen nga shpërndarja e rrezeve X dhe neutroneve në kënde të vogla, por johomogjenitete të tilla duhet të jenë të mëdha, të përbërë nga qindra molekula uji. Do të ishte e mundur t'i shihni ato duke studiuar shpërndarjen e dritës. Megjithatë, uji është një lëng jashtëzakonisht i qartë. Rezultati i vetëm i eksperimenteve të difraksionit është funksioni i shpërndarjes radiale, domethënë distanca midis atomeve të oksigjenit, hidrogjenit dhe oksigjen-hidrogjenit. Është e qartë prej tyre se nuk ka rregull me rreze të gjatë në rregullimin e molekulave të ujit. Këto funksione kalbet shumë më shpejt për ujin sesa për shumicën e lëngjeve të tjera. Për shembull, shpërndarja e distancave ndërmjet atomeve të oksigjenit në temperatura afër temperaturës së dhomës jep vetëm tre maksimum, në 2.8, 4.5 dhe 6.7. Maksimumi i parë korrespondon me distancën me fqinjët më të afërt, dhe vlera e tij është afërsisht e barabartë me gjatësinë e lidhjes hidrogjenore. Maksimumi i dytë është afër gjatësisë mesatare të një skaji tetraedroni: mbani mend se molekulat e ujit në akullin gjashtëkëndor ndodhen përgjatë kulmeve të një tetraedri të përshkruar rreth molekulës qendrore. Dhe maksimumi i tretë, i shprehur shumë dobët, korrespondon me distancën me fqinjët e tretë dhe më të largët në rrjetin e hidrogjenit. Ky maksimum në vetvete nuk është shumë i ndritshëm dhe nuk ka nevojë të flasim për majat e mëtejshme. Ka pasur përpjekje për të marrë informacion më të detajuar nga këto shpërndarje. Kështu në vitin 1969, I.S. Andrianov dhe I.Z. Fisher gjetën distancat deri te fqinji i tetë, ndërsa te fqinji i pestë rezultoi 3, dhe tek i gjashti 3.1. Kjo bën të mundur marrjen e të dhënave për mjedisin e largët të molekulave të ujit.
Një metodë tjetër e studimit të strukturës - difraksioni i neutronit në kristalet e ujit - kryhet saktësisht në të njëjtën mënyrë si difraksioni me rreze x. Megjithatë, për shkak të faktit se gjatësitë e shpërndarjes së neutroneve nuk ndryshojnë aq shumë midis atomeve të ndryshme, metoda e zëvendësimit izomorfik bëhet e papranueshme. Në praktikë, zakonisht punon me një kristal, struktura molekulare e të cilit tashmë është përcaktuar afërsisht nga metoda të tjera. Më pas maten intensitetet e difraksionit të neutronit për këtë kristal. Në bazë të këtyre rezultateve, kryhet një transformim Furier, gjatë të cilit përdoren intensitetet dhe fazat e matura të neutroneve, të llogaritura duke marrë parasysh atomet jo hidrogjen, d.m.th. atomet e oksigjenit, pozicioni i të cilëve në modelin e strukturës është i njohur. Pastaj, në hartën e Furierit të marrë në këtë mënyrë, atomet e hidrogjenit dhe deuteriumit janë paraqitur me pesha shumë më të mëdha se në hartën e densitetit të elektroneve, sepse kontributi i këtyre atomeve në shpërndarjen e neutroneve është shumë i madh. Duke përdorur këtë hartë të densitetit, për shembull, mund të përcaktoni pozicionet e atomeve të hidrogjenit (densiteti negativ) dhe deuteriumi (densiteti pozitiv).
Një variacion i kësaj metode është i mundur, i cili konsiston në faktin se kristali i formuar në ujë mbahet në ujë të rëndë përpara matjeve. Në këtë rast, difraksioni i neutronit jo vetëm që bën të mundur përcaktimin se ku ndodhen atomet e hidrogjenit, por gjithashtu identifikon ato prej tyre që mund të shkëmbehen për deuterium, gjë që është veçanërisht e rëndësishme kur studiohet shkëmbimi i izotopeve (H-D). Një informacion i tillë ndihmon për të konfirmuar se struktura është krijuar saktë.
Metoda të tjera gjithashtu bëjnë të mundur studimin e dinamikës së molekulave të ujit. Këto janë eksperimente mbi shpërndarjen pothuajse elastike të neutroneve, spektroskopinë ultra të shpejtë IR dhe studimin e difuzionit të ujit duke përdorur NMR ose atomet e deuteriumit të etiketuar. Metoda e spektroskopisë NMR bazohet në faktin se bërthama e një atomi hidrogjeni ka një moment magnetik - spin - që ndërvepron me fushat magnetike, konstante dhe të ndryshueshme. Nga spektri NMR mund të gjykohet se në çfarë mjedisi ndodhen këto atome dhe bërthama, duke marrë kështu informacion për strukturën e molekulës.
Si rezultat i eksperimenteve mbi shpërndarjen pothuajse elastike të neutroneve në kristalet e ujit, u mat parametri më i rëndësishëm - koeficienti i vetë-përhapjes në presione dhe temperatura të ndryshme. Për të gjykuar koeficientin e vetëdifuzionit nga shpërndarja kuazielastike e neutroneve, është e nevojshme të bëhet një supozim për natyrën e lëvizjes molekulare. Nëse ata lëvizin në përputhje me modelin e Ya.I. Frenkel (një fizikan teorik i famshëm rus, autor i "Teorisë Kinetike të Lëngjeve" - një libër klasik i përkthyer në shumë gjuhë), i quajtur gjithashtu modeli "kërcim në pritje", atëherë koha e jetës së vendosur (koha ndërmjet kërcimit) të një molekule është 3,2 pikosekonda. Metodat më të fundit të spektroskopisë me lazer femtosecond kanë bërë të mundur vlerësimin e jetëgjatësisë së një lidhjeje hidrogjeni të prishur: i duhen një protoni 200 fs për të gjetur një partner. Sidoqoftë, të gjitha këto janë vlera mesatare. Është e mundur të studiohen detajet e strukturës dhe natyrës së lëvizjes së molekulave të ujit vetëm me ndihmën e simulimit kompjuterik, i quajtur ndonjëherë një eksperiment numerik.

Kështu duket struktura e ujit sipas rezultateve të modelimit kompjuterik (sipas Doktorit të Shkencave Kimike G.G. Malenkov). Struktura e përgjithshme e çrregullt mund të ndahet në dy lloje rajonesh (të paraqitura si topa të errët dhe të lehta), të cilat ndryshojnë në strukturën e tyre, për shembull, në vëllimin e poliedrit Voronoi (a), shkalla e tetraedralitetit të mjedisit të afërt ( b), vlerën e energjisë potenciale (c), dhe gjithashtu në praninë e katër lidhjeve hidrogjenore në secilën molekulë (d). Megjithatë, këto zona fjalë për fjalë në një moment, pas disa pikosekondash, do të ndryshojnë vendndodhjen e tyre.
Simulimi kryhet në këtë mënyrë. Struktura e akullit merret dhe nxehet derisa të shkrihet. Më pas, pas njëfarë kohe që uji të harrojë origjinën e tij kristalore, bëhen mikrofotografi të menjëhershme.
Për të analizuar strukturën e ujit, zgjidhen tre parametra:
- shkalla e devijimit të mjedisit lokal të molekulës nga kulmet e një tetraedri të rregullt;
-energjia potenciale e molekulave;
-vëllimi i të ashtuquajturit shumëfaqësh Voronoi.
Për të ndërtuar këtë shumëfaqësh, merrni një skaj nga një molekulë e dhënë në atë më të afërt, ndajeni atë në gjysmë dhe vizatoni një rrafsh përmes kësaj pike pingul me skajin. Kjo jep vëllimin për molekulë. Vëllimi i një poliedri është dendësia, tetraedraliteti është shkalla e shtrembërimit të lidhjeve hidrogjenore, energjia është shkalla e qëndrueshmërisë së konfigurimit molekular. Molekulat me vlera të ngjashme të secilit prej këtyre parametrave priren të grupohen së bashku në grupime të veçanta. Të dy rajonet me densitet të ulët dhe me densitet të lartë kanë vlera të ndryshme energjetike, por ato gjithashtu mund të kenë të njëjtat vlera energjetike. Eksperimentet kanë treguar se zonat me struktura të ndryshme, grupimet lindin në mënyrë spontane dhe shpërbëhen në mënyrë spontane. E gjithë struktura e ujit është e gjallë dhe vazhdimisht ndryshon, dhe koha gjatë së cilës ndodhin këto ndryshime është shumë e shkurtër. Studiuesit monitoruan lëvizjet e molekulave dhe zbuluan se ato kryenin dridhje të parregullta me një frekuencë prej rreth 0,5 ps dhe një amplitudë prej 1 angstrom. Janë vërejtur gjithashtu kërcime të rralla të ngadalta të angstromave që zgjasin për pikosekonda. Në përgjithësi, në 30 ps një molekulë mund të lëvizë 8-10 angstrom. Jetëgjatësia e mjedisit lokal është gjithashtu e shkurtër. Rajonet e përbëra nga molekula me vlera të ngjashme vëllimi të poliedrit Voronoi mund të kalbet në 0,5 ps, ose mund të jetojnë për disa pikosekonda. Por shpërndarja e jetëgjatësisë së lidhjeve hidrogjenore është shumë e madhe. Por kjo kohë nuk i kalon 40 ps, dhe vlera mesatare është disa ps.
Si përfundim, duhet theksuar se Teoria e strukturës së grumbullimit të ujit ka shumë gracka. Për shembull, Zenin sugjeron se elementi kryesor strukturor i ujit është një grup prej 57 molekulash të formuara nga shkrirja e katër dodekaedronëve. Ata kanë fytyra të përbashkëta dhe qendrat e tyre formojnë një katërkëndësh të rregullt. Prej kohësh dihet se molekulat e ujit mund të vendosen në kulmet e një dodekaedri pesëkëndor; Një dodekaedron i tillë është baza e hidrateve të gazit. Prandaj, nuk ka asgjë befasuese në supozimin e ekzistencës së strukturave të tilla në ujë, megjithëse tashmë është thënë se asnjë strukturë specifike nuk mund të mbizotërojë dhe të ekzistojë për një kohë të gjatë. Prandaj është e çuditshme që ky element supozohet të jetë kryesori dhe që përmban saktësisht 57 molekula. Nga topat, për shembull, mund të mblidhni të njëjtat struktura, të cilat përbëhen nga dodekaedone ngjitur me njëri-tjetrin dhe përmbajnë 200 molekula. Zenin pretendon se procesi i polimerizimit tredimensional të ujit ndalon në 57 molekula. Sipas tij, nuk duhet të ketë bashkëpunëtorë më të mëdhenj. Sidoqoftë, nëse do të ishte kështu, kristalet gjashtëkëndore të akullit, të cilat përmbajnë një numër të madh molekulash të lidhura së bashku me lidhje hidrogjeni, nuk mund të precipitonin nga avujt e ujit. Nuk është aspak e qartë pse rritja e grupit Zenin u ndal në 57 molekula. Për të shmangur kontradiktat, Zenin grumbullon grupime në formacione më komplekse - rombohedra - me pothuajse një mijë molekula, dhe grupimet origjinale nuk formojnë lidhje hidrogjeni me njëra-tjetrën. Pse? Si ndryshojnë molekulat në sipërfaqen e tyre nga ato brenda? Sipas Zeninit, modeli i grupeve hidroksil në sipërfaqen e romboedroneve siguron kujtesën e ujit. Rrjedhimisht, molekulat e ujit në këto komplekse të mëdha janë të fiksuara në mënyrë të ngurtë, dhe vetë komplekset janë të ngurta. Një ujë i tillë nuk do të rrjedhë dhe pika e tij e shkrirjes, e cila lidhet me peshën molekulare, duhet të jetë shumë e lartë.
Cilat veti të ujit shpjegon modeli i Zeninit? Meqenëse modeli bazohet në struktura tetraedrale, ai mund të jetë pak a shumë në përputhje me të dhënat e difraksionit të rrezeve X dhe neutroneve. Megjithatë, nuk ka gjasa që modeli të mund të shpjegojë uljen e densitetit gjatë shkrirjes; paketimi i dodekaedronëve është më pak i dendur se akulli. Por është më e vështirë të pajtohesh me një model me veti dinamike - rrjedhshmëri, një vlerë të madhe të koeficientit të vetëdifuzionit, korrelacion të shkurtër dhe kohë relaksimi dielektrik, të cilat maten në pikosekonda.
Ph.D. O.V. Mosin
Referencat:
G.G. Malenkov. Përparimet në Kiminë Fizike, 2001
S.V.Zenin, B.M. Polanuer, B.V. Tyaglov. Prova eksperimentale e pranisë së fraksioneve të ujit. G. Mjekësia homeopatike dhe akupunktura. 1997.Nr.2.P.42-46.
S.V. Zenin, B.V. Tyaglov. Modeli hidrofobik i strukturës së bashkëpunëtorëve të molekulave të ujit. J. Kimi fizike 1994. T. 68. Nr. 4. P. 636-641.
S.V. Zenin Studimi i strukturës së ujit duke përdorur metodën e rezonancës magnetike të protonit. Dokl.RAN.1993.T.332.Nr.3.S.328-329.
S.V.Zenin, B.V.Tyaglov. Natyra e ndërveprimit hidrofobik. Shfaqja e fushave të orientimit në tretësirat ujore. J. Kimi fizike 1994. T. 68. Nr. 3. P. 500-503.
S.V. Zenin, B.V. Tyaglov, G.B. Sergeev, Z.A. Shabarova. Studimi i ndërveprimeve intramolekulare në nukleotidamide duke përdorur NMR. Materialet e Konf. 2-të Gjithë Bashkimit. Nga dinamika Stereokimia. Odessa.1975.f.53.
S.V. Zenin. Gjendja e strukturuar e ujit si bazë për kontrollin e sjelljes dhe sigurisë së sistemeve të jetesës. Teza. Doktor i Shkencave Biologjike. Qendra Shkencore Shtetërore "Instituti i Problemeve Mjekësore dhe Biologjike" (KSSH "IMBP"). Mbrojtur 1999. 05. 27. UDC 577.32:57.089.001.66.207 f.
NË DHE. Slesarev. Raporti i progresit të kërkimit
Universiteti Shtetëror Tambov me emrin. G.R. Derzhavinë
Revista Arsimore Soros, Vëllimi 6, Nr. 9, 2000
Uji dhe akulli: a dimë mjaftueshëm për to?
Ju. I. GOLOVIN
Janë përshkruar vetitë fizike të ujit dhe akullit. Diskutohen mekanizmat e dukurive të ndryshme në këto substanca. Pavarësisht periudhës së gjatë të studimit dhe përbërjes së thjeshtë kimike, uji dhe akulli – substancat janë shumë të vlefshme për jetën në tokë – përmbajnë shumë mistere për shkak të strukturës së tyre të ndërlikuar dinamike protonike dhe molekulare.Jepet një pasqyrë e shkurtër e vetive fizike të ujit dhe akullit. Shqyrtohen mekanizmat e dukurive të ndryshme në to. Është treguar se, pavarësisht historisë shekullore të studimit, përbërjes kimike më të thjeshtë dhe rëndësisë së jashtëzakonshme për jetën në Tokë, natyra e ujit dhe akullit është e mbushur me shumë mistere për shkak të strukturës komplekse dinamike të protonit dhe molekularit.
Edhe pse njerëzit kanë më shumë nevojë për thjeshtësi,
Megjithatë, kompleksi është më i qartë për ta.
B.L. Parsnip
Ndoshta nuk ka substancë më të përhapur dhe në të njëjtën kohë më misterioze në Tokë sesa uji në fazat e lëngëta dhe të ngurta. Në të vërtetë, mjafton të kujtojmë se të gjitha gjallesat vijnë nga uji dhe përbëhen nga më shumë se 50% e tij, se 71% e sipërfaqes së Tokës është e mbuluar me ujë dhe akull, dhe një pjesë e konsiderueshme e zonave të tokës veriore është e përhershme. Për të vizualizuar sasinë totale të akullit në planetin tonë, vërejmë se nëse ato shkrihen, uji në Oqeanin Botëror do të rritet me më shumë se 50 m, gjë që do të çojë në përmbytjen e zonave gjigante tokësore në të gjithë globin. Masa të mëdha akulli janë zbuluar në Univers, duke përfshirë Sistemin Diellor. Nuk ka asnjë prodhim apo aktivitet njerëzor pak a shumë të rëndësishëm në të cilin uji nuk përdoret. Në dekadat e fundit, rezerva të mëdha karburanti janë zbuluar në formën e hidrateve të ngurta të hidrokarbureve natyrore të ngjashme me akullin.
Në të njëjtën kohë, pas sukseseve të shumta në fizikën dhe kiminë fizike të ujit në vitet e fundit, vështirë se mund të argumentohet se vetitë e kësaj substance të thjeshtë janë plotësisht të kuptueshme dhe të parashikueshme. Ky artikull ofron një përmbledhje të shkurtër të vetive fizike më të rëndësishme të ujit dhe akullit dhe problemeve të pazgjidhura që lidhen kryesisht me fizikën e gjendjeve të tyre me temperaturë të ulët.
Kjo është një molekulë e ndërlikuar
Themelet e të kuptuarit modern të kimisë fizike të ujit u hodhën rreth 200 vjet më parë nga Henry Cavendish dhe Antoine Lavoisier, të cilët zbuluan se uji nuk është një element i thjeshtë kimik, siç besonin alkimistët mesjetarë, por një përbërje e oksigjenit dhe hidrogjenit në një. raport të caktuar. Në fakt, hidrogjeni (hidrogjeni) - i cili lind ujin - mori emrin e tij vetëm pas këtij zbulimi, dhe uji fitoi emërtimin e tij kimik modern, i njohur tashmë për çdo nxënës - H 2 O.
Pra, molekula H 2 O është ndërtuar nga dy atome hidrogjeni dhe një atom oksigjeni. Siç përcaktohet nga studimet e spektrit optik të ujit, në një gjendje hipotetike të mungesës së plotë të lëvizjes (pa lëkundje dhe rrotullime), jonet e hidrogjenit dhe oksigjenit duhet të zënë pozicione në kulmet e një trekëndëshi dykëndësh me një kënd në kulmin e zënë nga oksigjeni. prej 104,5° (Fig. 1, a). Në gjendjen e pangacmuar, distancat midis joneve H + dhe O 2− janë 0,96 Å. Falë kësaj strukture, molekula e ujit është një dipol, pasi dendësia e elektroneve në rajonin ku ndodhet joni O 2− është dukshëm më i lartë se në rajonin e joneve H +, dhe modeli më i thjeshtë - modeli i sferave - nuk është i përshtatshëm për përshkrimin e vetive të ujit. Mund të imagjinoni një molekulë uji në formën e një topi me dy fryrje të vogla në zonën ku ndodhen protonet (Fig. 1, b). Sidoqoftë, kjo nuk ndihmon për të kuptuar një veçori tjetër të ujit - aftësinë për të formuar lidhje të drejtuara hidrogjeni midis molekulave, të cilat luajnë një rol të madh në formimin e strukturës së tij të lirë, por në të njëjtën kohë shumë të qëndrueshme hapësinore, e cila përcakton pjesën më të madhe të vetitë fizike si në gjendje të lëngët ashtu edhe në gjendje të ngurtë.
Oriz. 1. Diagrami gjeometrik (a), modeli i sheshtë (b) dhe struktura elektronike hapësinore (c) e monomerit H 2 O. Dy nga katër elektronet në shtresën e jashtme të atomit të oksigjenit janë të përfshirë në krijimin e lidhjeve kovalente me atomet e hidrogjenit, dhe dy të tjera formojnë orbita elektronike shumë të zgjatura, rrafsh i cili është pingul me rrafshin H–O–H
Le të kujtojmë se një lidhje hidrogjeni është një lidhje midis atomeve në një molekulë ose molekulave fqinje që ndodh përmes një atomi hidrogjeni. Ai zë një pozicion të ndërmjetëm midis një lidhjeje kovalente dhe jovalente dhe formohet kur një atom hidrogjeni ndodhet midis dy atomeve elektronegativë (O, N, F, etj.). Elektroni në atomin H lidhet relativisht dobët me protonin, kështu që densiteti maksimal i elektronit zhvendoset në një atom më elektronegativ, dhe protoni ekspozohet dhe fillon të ndërveprojë me një atom tjetër elektronegativ. Në këtë rast, atomet O⋅⋅⋅O, N⋅⋅⋅O, etj., afrohen së bashku. në një distancë afër asaj që do të vendosej midis tyre në mungesë të atomit H. Lidhja hidrogjenore përcakton jo vetëm strukturën e ujit, por luan gjithashtu një rol jashtëzakonisht të rëndësishëm në jetën e biomolekulave: proteinat, karbohidratet, acidet nukleike etj. .
Natyrisht, për të shpjeguar natyrën e ujit është e nevojshme të merret parasysh struktura elektronike e molekulave të tij. Siç e dini, atomi i oksigjenit ka katër elektrone në shtresën e sipërme të tij, ndërsa hidrogjeni ka vetëm një elektron. Formimi i secilës lidhje kovalente O-H përfshin një elektron nga atomet e oksigjenit dhe hidrogjenit. Dy elektronet që mbeten në oksigjen quhen një çift i vetëm, pasi në një molekulë uji të izoluar ato mbeten të lira, duke mos marrë pjesë në formimin e lidhjeve brenda molekulës H 2 O. Por kur u afrohen molekulave të tjera, janë këto elektrone të vetme që luajnë një rol vendimtar në formimin e strukturës molekulare të ujit.
Elektronet e vetme zmbrapsen nga lidhjet O-H, kështu që orbitat e tyre janë fort të zgjatura në drejtim të kundërt me atomet e hidrogjenit, dhe planet orbitale rrotullohen në raport me rrafshin e formuar nga lidhjet O-H-O. Kështu, do të ishte më e saktë të përshkruhej një molekulë uji në hapësirën koordinative tredimensionale xyz në formën e një tetraedri, në qendër të të cilit ka një atom oksigjeni dhe në dy kulme ka një atom hidrogjeni (Fig. 1, c). Struktura elektronike e molekulave H 2 O përcakton kushtet për lidhjen e tyre në një rrjet kompleks tredimensional të lidhjeve hidrogjenore si në ujë ashtu edhe në akull. Secili nga protonet mund të formojë një lidhje me një elektron të vetëm të një molekule tjetër. Molekula e parë vepron si pranuese, dhe e dyta vepron si dhuruese, duke formuar një lidhje hidrogjeni. Për shkak se çdo molekulë H2O ka dy protone dhe dy elektrone të vetme, ajo mund të formojë katër lidhje hidrogjeni me molekula të tjera në të njëjtën kohë. Kështu, uji është një lëng kompleks i lidhur me një natyrë dinamike të lidhjeve, dhe një përshkrim i vetive të tij në nivel molekular është i mundur vetëm me ndihmën e modeleve mekanike kuantike me shkallë të ndryshme kompleksiteti dhe ashpërsie.
Akulli dhe vetitë e tij
Nga këndvështrimi i një personi mesatar, akulli është pak a shumë i njëjtë pavarësisht se ku formohet: në atmosferë si gurë breshër, në skajet e çatisë si akullnaja, ose në trupat ujorë si pllaka. Nga pikëpamja fizike, ka shumë lloje akulli, që ndryshojnë në strukturën e tyre molekulare dhe mesoskopike. Në akullin që ekziston në presion normal, secila molekulë H 2 O është e rrethuar nga katër të tjera, domethënë, numri i koordinimit të strukturës është katër (i ashtuquajturi akull I h). Rrjeta kristalore përkatëse - gjashtëkëndore - nuk është e mbushur ngushtë, prandaj dendësia e akullit të zakonshëm (~0,9 g/cm 3) është më e ulët se dendësia e ujit (~1 g/cm 3), për strukturën e të cilit, si Studimet e difraksionit me rreze X tregojnë se numri mesatar i koordinimit është ~ 4.4 (kundrejt 4 për akullin I h). Vetëm atomet e oksigjenit zënë pozicione fikse në strukturën e akullit. Dy atome hidrogjeni mund të zënë pozicione të ndryshme në katër lidhjet e molekulës H 2 O me fqinjët e tjerë. Për shkak të gjashtëkëndoritetit të grilës, kristalet që rriten në gjendje të lirë (për shembull, floket e borës) kanë një formë gjashtëkëndore.
Megjithatë, faza gjashtëkëndore është larg nga forma e vetme e ekzistencës së akullit. Numri i saktë i fazave të tjera kristalore - format polimorfike të akullit - është ende i panjohur. Ato formohen në presione të larta dhe në temperatura të ulëta (Fig. 2). Disa studiues e konsiderojnë praninë e 12 fazave të tilla si të vërtetuar saktësisht, ndërsa të tjerë i numërojnë ato deri në 14. Sigurisht, kjo nuk është e vetmja substancë që ka polimorfizëm (kujtoni, për shembull, grafitin dhe diamantin, të përbërë nga atome karboni kimikisht identike ), por numri i fazave të ndryshme të akullit, të cilat vazhdojnë të zbulohen edhe sot e kësaj dite, është i mahnitshëm. Të gjitha sa më sipër lidhen me rregullimin e renditur të joneve të oksigjenit në rrjetën kristalore të akullit. Sa për protonet - jonet e hidrogjenit - siç tregohet nga difraksioni i neutronit, ekziston një çrregullim i fortë në rregullimin e tyre. Kështu, akulli kristalor është edhe një mjedis i rregulluar mirë (në lidhje me oksigjenin) dhe në të njëjtën kohë një mjedis i çrregullt (në lidhje me hidrogjenin).

Oriz. 2. Diagrami i fazës së akullit kristalor.
Numrat romakë tregojnë zonat e ekzistencës
formimi i fazave të qëndrueshme. Ice IV është një fa- metastabile
për, e vendosur në diagramin brenda zonës V
Shpesh duket se akulli është i lakueshëm dhe i lëngshëm. Kjo është e vërtetë nëse temperatura është afër pikës së shkrirjes (d.m.th., t = 0°C në presionin atmosferik), dhe ngarkesa zbatohet për një kohë të gjatë. Dhe materiali më i fortë (për shembull, metali) në temperatura afër pikës së shkrirjes sillet në mënyrë të ngjashme. Deformimi plastik i akullit, si dhe i shumë lëndëve të tjera të ngurta kristalore, ndodh si rezultat i bërthamimit dhe lëvizjes së papërsosmërive të ndryshme strukturore nëpër kristal: boshllëqet, atomet intersticiale, kufijtë e kokrrizave dhe, më e rëndësishmja, zhvendosjet. Siç u vërtetua në vitet '30 të shekullit tonë, është prania e kësaj të fundit që paracakton një ulje të mprehtë të rezistencës së trupave të ngurtë kristalorë ndaj deformimit plastik (me 10 2 -10 4 herë në krahasim me rezistencën e një grilë ideale). Deri më sot, të gjitha llojet e dislokimeve karakteristike të strukturës gjashtëkëndore janë zbuluar në akull Ih dhe janë studiuar karakteristikat e tyre mikromekanike dhe elektrike.
Efekti i shkallës së sforcimit në vetitë mekanike të akullit me një kristal është ilustruar mirë në Fig. 3, marrë nga libri i N. Maeno. Mund të shihet se me një rritje të shkallës së deformimit, sforcimet mekanike σ të kërkuara për rrjedhën plastike rriten shpejt dhe shfaqet një dhëmb gjigant i rendimentit nga varësia e tendosjes relative E nga σ.

Oriz. 3.(Nga ). Lakoret e deformimit relativ të stresit për një kristal të vetëm akulli I h në t = -15°С (duke rrëshqitur përgjatë planit bazal të orientuar në një kënd prej 45° ndaj boshtit të ngjeshjes). Numrat në kthesa tregojnë shkallën relative të deformimit ( ∆l– ndryshimi i gjatësisë së mostrës l gjatë ∆τ
) në njësi prej 10 −7 s −1

Oriz. 4. Skema e formimit të defekteve në nënsistemin proton të akullit: a – një palë defekte jonike H 3 O + dhe OH –; b – çifti i defekteve orientuese Bjerrum D dhe L
Vetitë elektrike të akullit nuk janë më pak të jashtëzakonshme. Madhësia e përçueshmërisë dhe rritja e saj në mënyrë eksponenciale e shpejtë me rritjen e temperaturës dallojnë ndjeshëm akullin nga përçuesit metalikë dhe e vendosin atë në të njëjtin nivel me gjysmëpërçuesit. Akulli është zakonisht shumë i pastër kimikisht, edhe nëse rritet nga uji i ndotur ose tretësira (mendoni për copa akulli të pastra dhe transparente në një pellg të ndotur). Kjo është për shkak të tretshmërisë së ulët të papastërtive në strukturën e akullit. Si rezultat, gjatë ngrirjes, papastërtitë shtyhen në pjesën e përparme të kristalizimit në lëng dhe nuk hyjnë në strukturën e akullit. Kjo është arsyeja pse bora e sapo rënë është gjithmonë e bardhë, dhe uji prej saj është jashtëzakonisht i pastër.
Natyra ka siguruar me mençuri një stacion gjigant të pastrimit të ujit në të gjithë atmosferën e Tokës. Prandaj, nuk mund të mbështetet në përçueshmëri të lartë të papastërtive (si, për shembull, në silikon të dopuar) në akull. Por nuk ka elektrone të lira në të, si në metale. Vetëm në vitet 50 të shekullit të 20-të u vërtetua se transportuesit e ngarkesës në akull janë protone të çrregullt, domethënë akulli është një gjysmëpërçues protoni.
Kërcimi i protonit i përmendur më sipër krijon dy lloje defektesh në strukturën e akullit: jonike dhe orientuese (Fig. 4). Në rastin e parë, një kërcim protoni ndodh përgjatë një lidhjeje hidrogjeni nga një molekulë H 2 O në tjetrën (Fig. 4, a), duke rezultuar në formimin e një çifti defektesh jonike H 3 O + dhe OH -, dhe në së dyti - në një lidhje hidrogjeni ngjitur në një molekulë H 2 O (Fig. 4, b), si rezultat i së cilës lind një palë defektesh orientuese Bjerrum, të quajtura L dhe D-defekte (nga gjermanishtja leer - bosh dhe doppelt - dyfishtë ). Formalisht, një kërcim i tillë mund të konsiderohet si një rrotullim i molekulës H 2 O me 120 °.
Rrjedha e rrymës së drejtpërdrejtë për shkak të lëvizjes së vetëm defekteve jonike ose vetëm orientuese është e pamundur. Nëse, për shembull, një jon H 3 O + kalon nëpër një pjesë të rrjetit, atëherë joni tjetër i ngjashëm nuk do të jetë në gjendje të kalojë nëpër të njëjtën rrugë. Sidoqoftë, nëse një defekt D kalon përgjatë kësaj rruge, rregullimi i protoneve do të kthehet në atë origjinal dhe, për rrjedhojë, joni tjetër H 3 O + do të jetë në gjendje të kalojë. Ngjashëm sillen defektet OH - dhe L. Prandaj përçueshmëria elektrike e akullit të pastër kimikisht kufizohet nga ato defekte që janë më të vogla në numër, përkatësisht ato jonike. Polarizimi dielektrik, përkundrazi, është për shkak të defekteve më të shumta orientuese Bjerrum. Në fakt, kur aplikohet një fushë elektrike e jashtme, të dy proceset ndodhin paralelisht, gjë që lejon akullin të përçojë rrymë direkte dhe në të njëjtën kohë të përjetojë polarizim të fortë dielektrik, domethënë të shfaqë vetitë e një gjysmëpërçuesi dhe vetitë e një gjysmëpërçuesi. izolator. Vitet e fundit, përpjekjet kanë vazhduar për të zbuluar vetitë ferroelektrike dhe piezoelektrike të akullit të pastër në temperatura të ulëta si në masë ashtu edhe në kufijtë ndërfazor. Ende nuk ka besim të plotë në ekzistencën e tyre, megjithëse janë zbuluar disa efekte pseudo-piezoelektrike që lidhen me praninë e dislokimeve dhe defekteve të tjera strukturore.
Fizika e sipërfaqes dhe kristalizimi i akullit
Në lidhje me zhvillimin e teknologjisë gjysmëpërçuese, mikrominiturizimin e bazës së elementit dhe kalimin në teknologjitë planare, interesi për fizikën e sipërfaqes është rritur shumë në dekadën e fundit. Janë zhvilluar shumë teknika të sofistikuara për studimin e gjendjeve afër sipërfaqes në trupat e ngurtë, të cilat kanë rezultuar të dobishme në studimin e metaleve, gjysmëpërçuesve dhe dielektrikëve. Megjithatë, struktura dhe vetitë e sipërfaqes së akullit ngjitur me avullin ose lëngun mbeten kryesisht të paqarta. Një nga hipotezat më intriguese, e paraqitur nga M. Faraday, është ekzistenca në sipërfaqen e akullit të një shtrese thuajse të lëngshme dhjetëra deri në qindra angstrom të trashë, madje edhe në një temperaturë shumë nën pikën e shkrirjes. Baza për këtë nuk janë vetëm ndërtimet dhe teoritë spekulative të strukturës së shtresave afër sipërfaqes së molekulave shumë të polarizuara H 2 O, por edhe përcaktimet delikate (duke përdorur rezonancën magnetike bërthamore) të gjendjes fazore të sipërfaqes së akullit, si dhe të saj. përçueshmëria e sipërfaqes dhe varësia e saj nga temperatura. Megjithatë, në shumicën e rasteve praktikisht të rëndësishme, vetitë sipërfaqësore të borës dhe akullit me shumë gjasa përcaktohen nga prania e një filmi makroskopik uji dhe jo nga një shtresë pothuajse e lëngshme.
Shkrirja e shtresave sipërfaqësore të akullit nën ndikimin e dritës së diellit, një atmosferë më e ngrohtë ose një trup i fortë që rrëshqet mbi të (patinat, skitë, vrapuesit e sajë) është kritike për arritjen e një koeficienti të ulët fërkimi. Fërkimi i ulët i rrëshqitjes nuk është rezultat i uljes së temperaturës së shkrirjes nën ndikimin e presionit të shtuar, siç mendohet shpesh, por pasojë e lëshimit të nxehtësisë së fërkimit. Llogaritjet tregojnë se efekti i presionit, edhe në rastin e një patina të mprehtë që rrëshqet mbi akull, nën të cilën zhvillohet një presion prej rreth 1 MPa, çon në një ulje të temperaturës së shkrirjes me vetëm ~0,1°C, e cila nuk mund të ketë një efekt të rëndësishëm në sasinë e fërkimit.
Një traditë e vendosur në përshkrimin e vetive të ujit dhe akullit është deklarimi dhe diskutimi i shumë vetive anormale që e dallojnë këtë substancë midis homologëve të saj (H 2 S, H 2 Se, H 2 Te ). Ndoshta gjëja më e rëndësishme është nxehtësia specifike e shkrirjes (kristalizimi) dhe nxehtësia shumë e lartë (ndër substancave të thjeshta), domethënë, akulli është i vështirë për t'u shkrirë, dhe uji është i vështirë për t'u ngrirë. Si rezultat, klima në planetin tonë është përgjithësisht mjaft e butë, por në mungesë të ujit (për shembull, në shkretëtirat e Afrikës së nxehtë), kontrasti midis temperaturave të ditës dhe natës është shumë më i lartë sesa në bregdetin e oqeanit në të njëjtën kohë. gjerësi gjeografike. Jetësore për biosferën është vetia e rritjes së vëllimit gjatë kristalizimit dhe jo pakësimit, siç bëjnë shumica dërrmuese e substancave të njohura. Si rezultat, akulli noton në ujë në vend që të fundoset dhe ngadalëson shumë ngrirjen e trupave të ujit në mot të ftohtë, duke mbrojtur të gjitha gjallesat që strehohen në të për dimër. Kjo lehtësohet edhe nga ndryshimi jo monotonik i densitetit të ujit kur temperatura bie në 0°C - një nga vetitë anormale më të njohura të ujit, e zbuluar më shumë se 300 vjet më parë. Dendësia maksimale arrihet në t = 4°C dhe kjo parandalon që shtresat afër sipërfaqes së ujit që janë ftohur në një temperaturë nën 4°C të zhyten në fund. Përzierja konvektive e lëngut bllokohet, gjë që ngadalëson shumë ftohjen e mëtejshme. Anomalitë e tjera të ujit janë të njohura për një kohë të gjatë: viskoziteti i prerjes në 20°C, nxehtësia specifike në 40°C, kompresueshmëria izotermale në 46°C, shpejtësia e zërit në 60°C. Viskoziteti i ujit zvogëlohet me rritjen e presionit dhe nuk rritet, si lëngjet e tjera. Është e qartë se vetitë anormale të ujit janë për shkak të veçorive strukturore të molekulës së tij dhe specifikave të ndërveprimeve ndërmolekulare. Qartësi e plotë në lidhje me këtë të fundit ende nuk është arritur. Vetitë e përshkruara më sipër vlejnë për ujin, akullin dhe ndërfaqen ndërmjet tyre, që ekzistojnë në kushtet e ekuilibrit termodinamik. Probleme të një niveli kompleksiteti krejtësisht të ndryshëm lindin kur përpiqemi të përshkruajmë dinamikën e tranzicionit të fazës ujë-akulli, veçanërisht në kushte larg ekuilibrit termodinamik.
Shkaku termodinamik i çdo tranzicioni fazor është ndryshimi në potencialet kimike të grimcave në njërën anë dhe në anën tjetër të ndërfaqes ∆µ = µ1 −µ2. Potenciali kimik μ është një funksion i gjendjes që përcakton ndryshimet në potencialet termodinamike kur ndryshon numri N i grimcave në sistem, domethënë μ = G/N, ku G = H - TS është potenciali termodinamik i Gibbs, H është entalpi, S është entropi, T është temperatura. Dallimi në potencialet termodinamike është forca lëvizëse e një procesi makroskopik (ashtu si ndryshimi në potencialet elektrike në skajet e një përcjellësi është shkaku i rrymës elektrike). Në µ1 = µ2, të dyja fazat mund të bashkëjetojnë në ekuilibër për aq kohë sa të dëshirohet. Në presion normal, potenciali kimik i ujit është i barabartë me potencialin kimik të akullit në t = 0°C. Në t< 0°С более низким химическим потенциалом обладает лед, но это еще не означает, что при любом, самом маленьком переохлаждении начнется кристаллизация. Опыт показывает, что тщательно очищенный от примесей, обезгаженный, деионизированный расплав может быть переохлажден относительно точки равновесия фаз на десятки кельвин (а для некоторых веществ и на сотни). Анализ показывает, что причина заключается в отсутствии зародышей новой фазы (центров кристаллизации, конденсации, парообразования и т.д.).
Embrionet mund të formohen edhe në mënyrë homogjene, pra nga vetë mjedisi, i cili është në gjendje metastabile, por për këtë duhen plotësuar disa kushte. Le të fillojmë të shqyrtojmë situatën duke marrë parasysh faktin se çdo ndërfaqe midis kristalit dhe shkrirjes (ose avullit, tretësirës) sjell energji shtesë Sα, ku S është zona kufitare, α është energjia e sipërfaqes. Përveç kësaj, molekulat N që formuan kristalin e farës kanë një energji më të ulët se në lëng për NΔµ. Si rezultat, ndryshimi total i energjisë në sistem me shfaqjen e një bërthame ∆U = -N∆µ + Sα do të rezultojë të jetë jo monotonikisht i varur nga N. Në të vërtetë, për një formë sferike të bërthamës
![]()
ku A = (36πV 2) 1/3 V është vëllimi për një molekulë në kristal. Nga e mëparshmja rrjedh se ∆U arrin një maksimum ∆Uc = - N c ∆µ + AN c 2/3 α, kur bërthama përmban N c = (2Aα/3∆µ) 3 molekula.
Kështu, me shtimin sekuencial të molekulave në bërthamë, sistemi duhet së pari të ngjitet në majën e kodrës potenciale me një lartësi ∆U c, në varësi të superftohjes, pas së cilës do të ndodhë rritja e mëtejshme e N në kristal me një ulje të energji, pra më e lehtë. Duket se sa më e ulët të jetë temperatura e lëngut, domethënë sa më i fortë të jetë superftohja, aq më i shpejtë duhet të ndodhë kristalizimi. Ky është në fakt rasti kur hipotermia nuk është shumë e madhe. Megjithatë, ndërsa t zvogëlohet, viskoziteti i lëngut gjithashtu rritet në mënyrë eksponenciale, duke e bërë të vështirë lëvizjen e molekulave. Si rezultat, në shkallë të lartë superftohjeje, procesi i kristalizimit mund të zvarritet për shumë vite (siç është rasti me gotat me origjinë të ndryshme).
Vlerësimet numerike tregojnë se për ujin në shkallë normale të superftohjes në kushte natyrore (∆t = 1–10°C), embrioni duhet të përbëhet nga disa dhjetëra molekula, që është dukshëm më e madhe se numri i koordinimit në fazën e lëngshme (~4.4 ). Kështu, sistemi kërkon një numër të madh përpjekjesh luhatëse për t'u ngjitur në majën e kodrës së energjisë. Në ujin jo shumë të pastruar tërësisht, superftohja e fortë parandalohet nga prania e qendrave ekzistuese të kristalizimit, të cilat mund të jenë grimca papastërtie, grimca pluhuri, pabarazia e mureve të enës, etj. Më pas, kinetika e rritjes së kristalit varet nga kushtet. të transferimit të nxehtësisë pranë kufirit ndërfazor, si dhe të morfologjisë së këtij të fundit në nivel atomik.molekular.
Uji i tepërt i ftohur ka dy temperatura karakteristike t h = -36°C dhe t g = -140°C. Uji i pastruar mirë dhe i degazuar në intervalin e temperaturës 0°С > t > t h mund të qëndrojë në gjendjen e një lëngu të superftohur për një kohë të gjatë. Në t g< t < t h происходит гомогенное зарождение кристалликов льда, и вода не может находиться в переохлажденном состоянии при любой степени очистки. В условиях достаточно быстрого охлаждения при t < tg подвижность молекул воды настолько падает (а вязкость растет), что она образует стеклообразное твердое тело с аморфной структурой, свойственной жидкостям. При этом в области невысоких давлений образуется аморфная фаза низкой плотности, а в области повышенных – аморфная фаза высокой плотности, то есть вода демонстрирует полиаморфизм. При изменениях давления или температуры одна аморфная фаза скачком переходит в другую с неожиданно большим изменением плотности (>20%).
Ekzistojnë disa këndvështrime mbi natyrën e poliamorfizmit të ujit. Kështu, sipas , kjo sjellje e ujit shumë të ftohur fort mund të shpjegohet nëse pranojmë se në profilin potencial të bashkëveprimit të dy molekulave H2O ka më shumë se një minimum,

Oriz. 5(Nga ). Profilet hipotetike të potencialit: a – me një minimum energjie (për shembull, potenciali Lennard-Jones U(r) = A/r 6 − B/r 12) dhe b – me dy minimume energjie, të cilat korrespondojnë me dy konfigurime të qëndrueshme të një grup i dy molekulave ndërvepruese të ujit (1 dhe 2) me distanca të ndryshme ndërmjet qendrave të kushtëzuara të molekulave r H dhe r L; e para prej tyre korrespondon me një fazë me një densitet më të lartë, e dyta - me një më të ulët
dhe dy (Fig. 5). Pastaj faza amorfe me densitet të lartë do t'i përgjigjet distancës mesatare rH, dhe faza me densitet të ulët - rL. Modelimi kompjuterik konfirmon këtë këndvështrim, por nuk ka ende prova të besueshme eksperimentale për këtë hipotezë, as nuk ka një teori rigoroze që konfirmon vlefshmërinë e përdorimit të potencialit të puseve të dyfishta për të përshkruar vetitë e tilla të pazakonta të ujit të superftohur.
Sjellja e ujit të superftohur është me interes të madh për arsye të ndryshme. Në veçanti, përcakton kushtet klimatike, mundësinë dhe mënyrën e lundrimit në gjerësi të mëdha gjeografike, e cila është e rëndësishme për vendin tonë. Gjatë procesit të kristalizimit dinamik në ndërfaqe, ndodhin shumë dukuri interesante dhe ende pak të kuptuara, për shembull, rishpërndarja e papastërtive, ndarja dhe relaksimi i mëpasshëm i ngarkesave elektrike, shoqëruar nga rrezatimi elektromagnetik në një brez të gjerë frekuencash, etj. Së fundi, kristalizimi në një lëng shumë superftohës është i shkëlqyer, lehtësisht i riprodhueshëm shumë herë një situatë model e sjelljes së një sistemi që është larg ekuilibrit termodinamik dhe është i aftë, si rezultat i zhvillimit të paqëndrueshmërive, të formojë dendrite të rendit dhe dimensioneve të ndryshme ( Përfaqësuesit tipikë janë floket e dëborës dhe modelet e akullit në dritare), të përshtatshme për krijimin dhe modelimin e sjelljes së fraktaleve.
Në pamje të parë, proceset e shkrirjes së akullit duken më të lehta për t'u analizuar sesa proceset e kristalizimit. Megjithatë, ato lënë edhe shumë pyetje. Për shembull, besohet gjerësisht se uji i shkrirë për disa kohë ka veti të ndryshme nga vetitë e ujit të zakonshëm, të paktën në lidhje me objektet biologjike: bimët, kafshët, njerëzit. Ndoshta, këto veçori mund të jenë për shkak të pastërtisë së lartë kimike (për shkak të koeficientit të ulët të vërejtur të kapjes së papastërtive gjatë kristalizimit të akullit), ndryshimeve në përmbajtjen e gazeve dhe joneve të tretura, si dhe ruajtjen e strukturës së akullit në grupimet multimolekulare të lëngut. faza. Sidoqoftë, autori nuk ka informacion të besueshëm për këtë të marrë me metoda moderne fizike.
Jo më pak e vështirë është analiza e mekanizmave të ndikimit të fushave të jashtme fizike, në veçanti fushave magnetike, në proceset dhe vetitë e tranzicionit të ujit, akullit dhe fazës. E gjithë jeta jonë zhvillohet në kushtet e veprimit të vazhdueshëm të fushës magnetike të Tokës dhe luhatjeve të saj të dobëta. Magnetobiologjia dhe metodat e trajtimit magnetik në mjekësi janë zhvilluar për shumë shekuj. Së fundi, njësitë prodhohen në masë dhe përdoren gjerësisht për magnetizimin e ujit që përdoret për ujitje në bujqësi (me qëllim rritjen e produktivitetit), fuqizimin e kaldajave me avull (për të zvogëluar shkallën e formimit të shkallës në to), etj. Megjithatë, ende nuk ka një përshkrim fizik të kënaqshëm të mekanizmave të veprimit të fushës magnetike në këto dhe raste të tjera të ngjashme.
konkluzioni
Uji, akulli dhe transformimet e tyre të ndërsjella të fazës janë ende të mbushura me shumë mistere. Zgjidhja e tyre nuk është vetëm një problem fizik shumë interesant, por është edhe jashtëzakonisht i rëndësishëm për jetën në Tokë, pasi lidhet drejtpërdrejt me shëndetin dhe mirëqenien e njeriut. Ndoshta ato ofrojnë një nga shembujt më të mrekullueshëm të rolit të strukturës elektronike dhe molekulare në formimin e vetive fizike të përbërjes kimike më të thjeshtë dhe më të njohur të një substance.
Literatura:
1. Bogorodsky V.V., Gavrilo V.P. Akull. L.: Gidrometeoizdat, 1980. 384 f.
2. Maeno N. Shkenca e akullit. M.: Mir, 1988. 231 f.
3. Hobbs P.V. Fizika e akullit. Oxford: Univ. Shtypi, 1974. 864 f.
4. Zatsepina G.N. Vetitë fizike dhe struktura e ujit. M.: Shtëpia Botuese e Universitetit Shtetëror të Moskës, 1998. 184 f.
5. Mishima O., Stanley E. Marrëdhënia midis ujit të lëngshëm, super të ftohtë dhe të qelqtë // Natyra. 1998. Vëll. 396. faqe 329–335.
6. Zolotukhin I.V. Fraktalet në fizikën e gjendjes së ngurtë // Revista Arsimore Soros. 1998. Nr 7. faqe 108–113. Rishikuesi i artikullit B.A. Strukov
Yuri Ivanovich Golovin, Doktor i Shkencave Fizike dhe Matematikore, Profesor, Drejtor. Departamenti i Fizikës Teorike dhe Eksperimentale, Universiteti Shtetëror Tambov. G.R. Derzhavin, Shkencëtar i nderuar i Federatës Ruse. Fusha e interesave shkencore është struktura elektronike e defekteve në trupat e ngurtë dhe vetitë makroskopike të shkaktuara prej tyre. Autor dhe bashkautor i më shumë se 200 punimeve shkencore, duke përfshirë monografi dhe 40 shpikje.
Akull- mineral me kimik formula H 2 O, përfaqëson ujin në gjendje kristalore.
Përbërja kimike e akullit: H - 11,2%, O - 88,8%. Ndonjëherë ai përmban papastërti mekanike të gazta dhe të ngurta.
Në natyrë, akulli përfaqësohet kryesisht nga një nga disa modifikime kristalore, të qëndrueshme në intervalin e temperaturës nga 0 në 80°C, me një pikë shkrirjeje prej 0°C. Janë të njohura 10 modifikime kristalore të akullit dhe akullit amorf. Më i studiuari është akulli i modifikimit të parë - i vetmi modifikim që gjendet në natyrë. Akulli gjendet në natyrë në formën e vetë akullit (kontinental, lundrues, nëntokësor etj.), si dhe në formën e borës, ngricës etj.
Shiko gjithashtu:
STRUKTURA
Struktura kristalore e akullit është e ngjashme me strukturën: secila molekulë H 2 0 është e rrethuar nga katër molekulat më të afërta me të, të vendosura në distanca të barabarta prej tij, të barabarta me 2,76Α dhe të vendosura në kulmet e një tetraedri të rregullt. Për shkak të numrit të ulët të koordinimit, struktura e akullit është e hapur, gjë që ndikon në densitetin e saj (0.917). Akulli ka një rrjetë hapësinore gjashtëkëndore dhe formohet nga ngrirja e ujit në 0°C dhe presioni atmosferik. Rrjeta e të gjitha modifikimeve kristalore të akullit ka një strukturë tetraedrale. Parametrat e një qelize njësi akulli (në t 0°C): a=0,45446 nm, c=0,73670 nm (c është dyfishi i distancës ndërmjet planeve kryesore ngjitur). Kur temperatura bie, ato ndryshojnë shumë pak. Molekulat H 2 0 në rrjetën e akullit janë të lidhura me njëra-tjetrën me lidhje hidrogjenore. Lëvizshmëria e atomeve të hidrogjenit në rrjetën e akullit është shumë më e lartë se lëvizshmëria e atomeve të oksigjenit, për shkak të së cilës molekulat ndryshojnë fqinjët e tyre. Në prani të lëvizjeve të rëndësishme vibruese dhe rrotulluese të molekulave në rrjetën e akullit, ndodhin kërcime përkthimore të molekulave nga vendi i lidhjes së tyre hapësinore, duke prishur rendin e mëtejshëm dhe duke formuar dislokime. Kjo shpjegon shfaqjen e vetive specifike reologjike në akull, të cilat karakterizojnë marrëdhënien midis deformimeve (rrjedhjes) të pakthyeshme të akullit dhe sforcimeve që i shkaktuan ato (plasticiteti, viskoziteti, stresi i rendimentit, zvarritja, etj.). Për shkak të këtyre rrethanave, akullnajat rrjedhin në mënyrë të ngjashme me lëngjet shumë viskoze, dhe kështu akulli natyror merr pjesë aktive në ciklin e ujit në Tokë. Kristalet e akullit janë relativisht të mëdha në madhësi (madhësia tërthore nga fraksionet e një milimetri në disa dhjetëra centimetra). Ato karakterizohen nga anizotropia e koeficientit të viskozitetit, vlera e të cilit mund të ndryshojë me disa renditje të madhësisë. Kristalet janë të afta të riorientohen nën ndikimin e ngarkesave, gjë që ndikon në metamorfizimin e tyre dhe shpejtësinë e rrjedhës së akullnajave.
VETITË

Akulli është i pangjyrë. Në grupe të mëdha ajo merr një nuancë kaltërosh. Shkëlqim xhami. Transparente. Nuk ka dekolte. Fortësia 1.5. E brishtë. Optikisht pozitiv, indeksi i thyerjes shumë i ulët (n = 1,310, nm = 1,309). Janë 14 modifikime të njohura të akullit në natyrë. Vërtetë, gjithçka përveç akullit të njohur, i cili kristalizohet në sistemin gjashtëkëndor dhe është caktuar si akull I, formohet në kushte ekzotike - në temperatura shumë të ulëta (rreth -110150 0C) dhe presione të larta, kur këndet e lidhjeve hidrogjenore në ujë ndryshimi i molekulës dhe formohen sisteme, të ndryshme nga gjashtëkëndore. Kushtet e tilla ngjajnë me ato në hapësirë dhe nuk ndodhin në Tokë. Për shembull, në temperaturat nën -110 °C, avulli i ujit precipiton në një pllakë metalike në formën e oktaedrave dhe kube disa nanometra në madhësi - ky është i ashtuquajturi akull kub. Nëse temperatura është pak mbi -110 °C dhe përqendrimi i avullit është shumë i ulët, në pjatë formohet një shtresë akulli jashtëzakonisht i dendur amorf.
MORFOLOGJIA

Akulli është një mineral shumë i zakonshëm në natyrë. Ka disa lloje akulli në koren e tokës: lumë, liqen, det, tokë, bredh dhe akullnajë. Më shpesh formon grupe agregate të kokrrave të imta kristalore. Njihen edhe formacionet kristalore të akullit që lindin nga sublimimi, domethënë drejtpërdrejt nga gjendja e avullit. Në këto raste, akulli shfaqet si kristale skeletore (flokë dëbore) dhe agregate të rritjes skeletore dhe dendritike (akulli i shpellës, ngrica e nxehtë, ngrica e ujit dhe modele në xhami). Gjenden kristale të mëdha të prera mirë, por shumë rrallë. N. N. Stulov përshkroi kristalet e akullit në pjesën verilindore të Rusisë, të gjetur në një thellësi 55-60 m nga sipërfaqja, me një pamje izometrike dhe kolone, dhe gjatësia e kristalit më të madh ishte 60 cm, dhe diametri i bazës së tij ishte 15 cm Nga format e thjeshta në kristalet e akullit, u identifikuan vetëm faqet e prizmit gjashtëkëndor (1120), bipiramidës gjashtëkëndore (1121) dhe pinakoidit (0001).
Stalaktitet e akullit, të quajtura në gjuhën e folur "akullore", janë të njohur për të gjithë. Me ndryshime temperaturash prej rreth 0° në stinët vjeshtë-dimër, ato rriten kudo në sipërfaqen e Tokës me ngrirjen (kristalizimin) e ngadaltë të ujit që rrjedh dhe pikon. Ato janë gjithashtu të zakonshme në shpellat e akullit.
Bregjet e akullit janë shirita mbulese akulli të bëra nga akulli që kristalizohet në kufirin ujë-ajër përgjatë skajeve të rezervuarëve dhe kufizohet me skajet e pellgjeve, brigjeve të lumenjve, liqeneve, pellgjeve, rezervuarëve, etj. me pjesën tjetër të hapësirës ujore që nuk ngrin. Kur ato rriten plotësisht së bashku, në sipërfaqen e rezervuarit formohet një mbulesë e vazhdueshme akulli.
Akulli gjithashtu formon agregate kolone paralele në formën e venave fibroze në tokat poroze dhe antolite akulli në sipërfaqen e tyre.
ORIGJINA

Akulli formohet kryesisht në pellgjet ujore kur temperatura e ajrit bie. Në të njëjtën kohë, në sipërfaqen e ujit shfaqet një qull akulli i përbërë nga hala akulli. Nga poshtë, mbi të rriten kristale të gjata akulli, boshtet e simetrisë së rendit të gjashtë të të cilëve janë pingul me sipërfaqen e kores. Marrëdhëniet midis kristaleve të akullit në kushte të ndryshme formimi janë paraqitur në Fig. Akulli është i zakonshëm kudo ku ka lagështi dhe ku temperatura bie nën 0°C. Në disa zona, akulli në tokë shkrihet vetëm në një thellësi të cekët, nën të cilën fillon ngrirja e përhershme. Këto janë të ashtuquajturat zona të permafrostit; Në zonat e shpërndarjes së permafrostit në shtresat e sipërme të kores së tokës, gjendet i ashtuquajturi akull nëntokësor, ndër të cilët dallohen akulli nëntokësor modern dhe fosil. Të paktën 10% e sipërfaqes totale të tokës është e mbuluar nga akullnajat; shkëmbi monolit i akullit që i përbën ato quhet akull akullnajor. Akulli akullnajor formohet kryesisht nga akumulimi i borës si rezultat i ngjeshjes dhe transformimit të tij. Shtresa e akullit mbulon rreth 75% të Grenlandës dhe pothuajse të gjithë Antarktidën; trashësia më e madhe e akullnajave (4330 m) ndodhet afër stacionit Byrd (Antarktidë). Në Grenlandën qendrore trashësia e akullit arrin 3200 m.
Depozitat e akullit janë të njohura. Në zonat me dimër të ftohtë, të gjatë dhe verë të shkurtër, si dhe në rajone të larta malore, formohen shpella akulli me stalaktite dhe stalagmite, ndër të cilat më interesantet janë Kungurskaya në rajonin Perm të Uraleve, si dhe shpella Dobshine në Sllovakia.
Kur uji i detit ngrin, formohet akulli i detit. Vetitë karakteristike të akullit të detit janë kripësia dhe poroziteti, të cilat përcaktojnë diapazonin e densitetit të tij nga 0,85 në 0,94 g/cm 3 . Për shkak të një densiteti kaq të ulët, flotat e akullit ngrihen mbi sipërfaqen e ujit me 1/7-1/10 të trashësisë së tyre. Akulli i detit fillon të shkrihet në temperatura mbi -2,3°C; është më elastik dhe më i vështirë për t'u copëtuar sesa akulli i ujit të ëmbël.
APLIKACION

Në fund të viteve 1980, laboratori Argonne zhvilloi një teknologji për prodhimin e llumit të akullit që mund të rrjedhë lirshëm nëpër tuba me diametra të ndryshëm pa u grumbulluar në grumbullime akulli, duke u ngjitur së bashku ose duke bllokuar sistemet e ftohjes. Pezullimi i ujit të kripur përbëhej nga shumë kristale akulli shumë të vogla në formë të rrumbullakët. Falë kësaj, ruhet lëvizshmëria e ujit dhe, në të njëjtën kohë, nga pikëpamja e inxhinierisë termike, ai përfaqëson akullin, i cili është 5-7 herë më efektiv se uji i thjeshtë i ftohtë në sistemet e ftohjes së ndërtesave. Për më tepër, përzierje të tilla janë premtuese për mjekësinë. Eksperimentet në kafshë kanë treguar se mikrokristalet e përzierjes së akullit kalojnë në mënyrë të përsosur në enë mjaft të vogla të gjakut dhe nuk dëmtojnë qelizat. "Gjaku i akullt" zgjat kohën gjatë së cilës viktima mund të shpëtohet. Le të themi, në rast arresti kardiak, kjo kohë zgjat, sipas vlerësimeve konservatore, nga 10-15 në 30-45 minuta.
Përdorimi i akullit si material strukturor është i përhapur në rajonet polare për ndërtimin e banesave - igloos. Akulli është pjesë e materialit Pikerit të propozuar nga D. Pike, nga i cili u propozua të bëhej aeroplanmbajtësja më e madhe në botë.
Akull - H 2 O
KLASIFIKIMI
| Strunz (botimi i 8-të) | 4/A.01-10 |
| Nickel-Strunz (botimi i 10-të) | 4.AA.05 |
| Dana (edicioni i 8-të) | 4.1.2.1 |
| Hey's CIM Ref. | 7.1.1 |