Struktura vode. Svojstva vode Glavne razlike između leda i vode na molekularnoj razini
Od 14 trenutno poznatih oblika čvrste vode u prirodi nalazimo samo jedan – led. Ostali nastaju u ekstremnim uvjetima i nedostupni su za promatranje izvan posebnih laboratorija. Najintrigantnije svojstvo leda je njegova nevjerojatna raznolikost vanjskih manifestacija. Uz istu kristalnu strukturu, može izgledati potpuno drugačije, poprimajući oblik prozirnih zrna tuče i ledenica, pahuljica pahuljastog snijega, guste sjajne kore jele na snježnom polju ili divovskih ledenjačkih masa.
U malom japanskom gradu Kaga, smještenom na zapadnoj obali otoka Honshu, nalazi se neobičan muzej. Snijeg i led. Osnovao ju je Ukihiro Nakaya, prvi koji je u laboratoriju naučio uzgajati umjetne pahulje, lijepe poput onih koje padaju s neba. U ovom muzeju posjetitelji su sa svih strana okruženi pravilnim šesterokutima, jer je upravo ta “heksagonalna” simetrija karakteristična za obične kristale leda (usput rečeno, grčka riječ kristallos zapravo znači “led”). Određuje mnoga njegova jedinstvena svojstva i čini da snježne pahulje, uz svu njihovu beskrajnu raznolikost, rastu u obliku zvijezda sa šest, rjeđe s tri ili dvanaest zraka, ali nikad s četiri ili pet.
Molekule u ažuru
Ključ strukture čvrste vode leži u strukturi njezine molekule. H2O se može pojednostavljeno prikazati kao tetraedar (piramida s trokutastom bazom). U središtu je kisik, u dva vrha nalazi se vodik, točnije proton, čiji elektroni sudjeluju u stvaranju kovalentne veze s kisikom. Dva preostala vrha zauzimaju parovi valentnih elektrona kisika, koji ne sudjeluju u stvaranju intramolekulskih veza, zbog čega se nazivaju usamljenim.
Kada proton jedne molekule stupa u interakciju s parom usamljenih elektrona kisika druge molekule, formira se vodikova veza, manje jaka od intramolekularne veze, ali dovoljno snažna da susjedne molekule drži zajedno. Svaka molekula može istovremeno formirati četiri vodikove veze s drugim molekulama pod strogo definiranim kutovima, koji ne dopuštaju stvaranje guste strukture kada se zamrznu. Ovaj nevidljivi okvir vodikovih veza raspoređuje molekule u čipkastu mrežu sa šupljim kanalima. Čim se led zagrije, čipka se uruši: molekule vode počinju padati u šupljine mreže, što dovodi do gušće strukture tekućine, zbog čega je voda teža od leda.Led, koji nastaje pri atmosferskom tlaku i topi se pri 0°C, najčešća je tvar, ali još uvijek nije u potpunosti razjašnjena. Mnogo toga u svojoj strukturi i svojstvima izgleda neobično. Na mjestima kristalne rešetke leda, atomi kisika raspoređeni su na uredan način, tvoreći pravilne šesterokute, ali atomi vodika zauzimaju različite položaje duž veza. Ovakvo ponašanje atoma općenito je netipično - u pravilu, u čvrstoj tvari svi se pokoravaju istom zakonu: ili su svi atomi raspoređeni na uredan način, i tada je to kristal, ili nasumično, i tada je to amorfna tvar.
Led je teško otopiti, koliko god to čudno zvučalo. Da nema vodikovih veza koje drže molekule vode zajedno, ona bi se topila na 90°C. Istodobno, kada se voda smrzne, ne smanjuje se u volumenu, kao što se događa s većinom poznatih tvari, već se povećava zbog stvaranja otvorene strukture leda.“Čudnoće” leda također uključuju stvaranje elektromagnetskog zračenja njegovim rastućim kristalima. Odavno je poznato da se većina nečistoća otopljenih u vodi ne prenosi na led kad počne rasti, drugim riječima, ledi se. Stoga je i na najprljavijoj lokvi ledeni film čist i proziran. Nečistoće se nakupljaju na granici između krutih i tekućih medija, u obliku dva sloja električnih naboja različitih predznaka, koji uzrokuju značajnu razliku potencijala. Nabijeni sloj nečistoća kreće se zajedno s donjom granicom mladog leda i emitira elektromagnetske valove. Zahvaljujući tome može se detaljno promatrati proces kristalizacije. Dakle, kristal koji raste u dužinu u obliku igle drugačije zrači od onog prekrivenog bočnim nastavcima, a zračenje rastućih zrnaca razlikuje se od onog koje nastaje pri pucanju kristala. Po obliku, redoslijedu, frekvenciji i amplitudi impulsa zračenja može se odrediti kojom brzinom se led smrzava i kakva se struktura leda dobiva.
Pogrešan led
U čvrstom stanju voda ima, prema najnovijim podacima, 14 strukturnih modifikacija. Neki od njih su kristalni (većina njih), neki su amorfni, ali se svi međusobno razlikuju po relativnom rasporedu molekula vode i svojstvima. Istina, sve osim nama poznatog leda nastaje u egzotičnim uvjetima - pri vrlo niskim temperaturama i visokim tlakovima, kada se mijenjaju kutovi vodikovih veza u molekuli vode i nastaju sustavi koji nisu heksagonalni. Na primjer, na temperaturama nižim od 110°C vodena para se taloži na metalnu ploču u obliku oktaedra i kockica veličine nekoliko nanometara - to je tzv. kubični led. Ako je temperatura malo iznad 110°, a koncentracija pare vrlo niska, na ploči se stvara sloj izuzetno gustog amorfnog leda.
Posljednje dvije modifikacije leda XIII i XIV znanstvenici s Oxforda otkrili su nedavno, 2006. godine. 40 godina staro predviđanje da bi trebali postojati kristali leda s monoklinskom i rombičnom rešetkom bilo je teško potvrditi: viskoznost vode na temperaturi od 160 °C vrlo je visoka, a molekule ultra čiste prehlađene vode okupljaju se u takvim količinama formirati kristalnu jezgru, teško. Pomogao je katalizator: klorovodična kiselina, koja je povećala pokretljivost molekula vode na niskim temperaturama. Takve modifikacije leda ne mogu nastati u zemaljskoj prirodi, ali ih je moguće tražiti na zaleđenim satelitima drugih planeta.
Komisija je tako odlučilaSnježna pahulja je pojedinačni kristal leda, varijacija na temu šesterokutnog kristala, ali koji je brzo rastao u neravnotežnim uvjetima. I najradoznaliji umovi stoljećima se bore s tajnom njihove ljepote i beskrajne raznolikosti. Astronom Johannes Kepler napisao je cijelu raspravu "O šesterokutnim snježnim pahuljama" 1611. godine. Godine 1665. Robert Hooke je u golemom svesku skica svega što je vidio mikroskopom objavio mnogo crteža snježnih pahulja raznih oblika. Prvu uspješnu fotografiju pahulje pod mikroskopom snimio je 1885. američki farmer Wilson Bentley. Od tada više nije mogao stati. Do kraja života, više od četrdeset godina, Bentley ih je fotografirao. Više od pet tisuća kristala, a niti jedan nije isti.
Najpoznatiji sljedbenici Bentleyeve stvari su već spomenuti Ukihiro Nakaya i američki fizičar Kenneth Libbrecht. Nakaya je prvi sugerirao da veličina i oblik snježnih pahuljica ovisi o temperaturi zraka i sadržaju vlage, a tu je hipotezu sjajno eksperimentalno potvrdio uzgojem kristala leda različitih oblika u laboratoriju. A Libbrecht je čak počeo uzgajati snježne pahulje unaprijed određenog oblika po narudžbi.
Život snježne pahulje počinje stvaranjem kristalnih jezgri leda u oblaku vodene pare kako temperatura pada. Središte kristalizacije mogu biti čestice prašine, bilo koje čvrste čestice ili čak ioni, ali u svakom slučaju ti komadići leda manji od desetinke milimetra već imaju heksagonalnu kristalnu rešetku.
Vodena para, kondenzirajući se na površini tih jezgri, najprije oblikuje sićušnu šesterokutnu prizmu iz čijih šest uglova počinju rasti potpuno identične ledene iglice i bočni izdanci. One su iste jednostavno zato što su temperatura i vlažnost oko embrija također iste. Na njima pak rastu bočni izdanci i grane, kao na stablu. Takvi se kristali nazivaju dendriti, to jest slični drvu.
Krećući se gore-dolje u oblaku, snježna pahulja nailazi na uvjete s različitim temperaturama i koncentracijama vodene pare. Njegov oblik se mijenja, poštujući zakone heksagonalne simetrije do posljednjeg. Tako pahuljice postaju drugačije. Iako teoretski, u istom oblaku na istoj visini, mogu “izroniti” identični. Ali svaka ima svoj put do tla, koji je prilično dugačak; u prosjeku pahulja pada brzinom od 0,9 km na sat. To znači da svaki ima svoju povijest i svoj konačni oblik. Led koji oblikuje snježnu pahulju je proziran, ali kada ga ima mnogo, sunčeva svjetlost, reflektirana i raspršena na brojnim stranama, daje dojam bijele neprozirne mase - zovemo je snijeg.
Kako bi se izbjegla zabuna s raznolikošću snježnih pahulja, Međunarodna komisija za snijeg i led usvojila je 1951. prilično jednostavnu klasifikaciju ledenih kristala: ploče, zvjezdasti kristali, stupovi ili stupovi, iglice, prostorni dendriti, stupovi s vrhovima i nepravilni oblici. I još tri vrste ledenih oborina: sitna snježna kugla, ledena kugla i tuča.Rast inja, inja i šara na staklu podliježu istim zakonitostima. Ove pojave, poput snježnih pahulja, nastaju kondenzacijom, molekula po molekula, na tlu, travi, drveću. Uzorci na prozoru pojavljuju se u mraznom vremenu, kada se vlaga iz toplog sobnog zraka kondenzira na površini stakla. Ali zrna tuče nastaju kada se kapljice vode smrznu ili kada se led u oblacima zasićenim vodenom parom smrzne u gustim slojevima na zametke snježnih pahulja. Druge, već formirane pahulje mogu se zamrznuti na zrna tuče, stapati se s njima, zbog čega zrna tuče poprimaju najbizarnije oblike.
Nama na Zemlji dovoljna je jedna čvrsta modifikacija vode – obični led. Doslovno prožima sve prostore ljudskog obitavanja ili boravka. Skupljajući se u ogromnim količinama, snijeg i led tvore posebne strukture sa svojstvima koja se bitno razlikuju od pojedinačnih kristala ili snježnih pahulja. Planinski ledenjaci, ledeni pokrivači vodenih površina, permafrost i jednostavno sezonski snježni pokrivač značajno utječu na klimu velikih regija i planeta u cjelini: čak i oni koji nikada nisu vidjeli snijeg osjećaju dah njegovih masa nakupljenih na Zemljinim polovima, jer na primjer, u obliku dugotrajnih fluktuacija razine Svjetskog oceana. A led je toliko važan za izgled našeg planeta i ugodno stanište živih bića na njemu da su znanstvenici za njega izdvojili posebno okruženje - kriosferu, koja se proteže visoko u atmosferu i duboko u zemljinu koru.
Olga Maksimenko, kandidat kemijskih znanosti
Prilagođeno pretraživanje
Struktura vode
dr.sc. O.V. Mosin
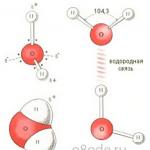
Molekula vode mali je dipol koji na svojim polovima sadrži pozitivne i negativne naboje. Budući da su masa i naboj jezgre kisika veći od jezgri vodika, elektronski oblak se povlači prema jezgri kisika. U ovom slučaju, jezgre vodika su izložene. Dakle, elektronski oblak ima nejednoliku gustoću. U blizini jezgri vodika postoji manjak elektronske gustoće, a na suprotnoj strani molekule, u blizini jezgre kisika, postoji višak elektronske gustoće. Upravo ta struktura određuje polaritet molekule vode. Spojite li epicentre pozitivnih i negativnih naboja ravnim linijama, dobit ćete trodimenzionalni geometrijski lik - pravilan tetraedar.
 Struktura molekule vode (slika desno)
Struktura molekule vode (slika desno)
Zbog prisutnosti vodikovih veza, svaka molekula vode formira vodikovu vezu sa 4 susjedne molekule, tvoreći ažurni mrežasti okvir u molekuli leda. Međutim, u tekućem stanju voda je nesređena tekućina; Ove vodikove veze su spontane, kratkotrajne, brzo pucaju i ponovno se formiraju. Sve to dovodi do heterogenosti strukture vode.
 Vodikove veze između molekula vode (slika dolje lijevo)
Vodikove veze između molekula vode (slika dolje lijevo)
Da je voda heterogena po sastavu utvrđena je davno. Odavno je poznato da led pluta na površini vode, odnosno da je gustoća kristalnog leda manja od gustoće tekućine.
Za gotovo sve ostale tvari kristal je gušći od tekuće faze. Osim toga, čak i nakon topljenja, s povećanjem temperature, gustoća vode nastavlja rasti i doseže maksimum na 4C. Manje je poznata anomalija stlačivosti vode: zagrijavanjem od tališta do 40C ona se smanjuje, a zatim raste. Toplinski kapacitet vode također nemonotono ovisi o temperaturi.
Osim toga, pri temperaturama nižim od 30C, s porastom tlaka od atmosferskog do 0,2 GPa, viskoznost vode se smanjuje, a koeficijent samodifuzije, parametar koji određuje brzinu gibanja molekula vode jedna u odnosu na drugu, raste.
Za druge tekućine odnos je suprotan i gotovo nigdje se ne događa da se neki važan parametar ponaša nemonotono, tj. prvo se povećao, a nakon prolaska kritične vrijednosti temperature ili tlaka smanjio. Pojavila se pretpostavka da zapravo voda nije jedna tekućina, već mješavina dviju komponenti koje se razlikuju po svojstvima, na primjer, gustoći i viskoznosti, a time i strukturi. Takve ideje počele su se javljati krajem 19. stoljeća, kada se nakupilo mnogo podataka o anomalijama vode.
Whiting je prvi iznio ideju da se voda sastoji od dvije komponente 1884. godine. Njegovo autorstvo navodi E. F. Fritsman u monografiji "Priroda vode. Teška voda", objavljenoj 1935. godine. V. Rengten je 1891. uveo koncept dvaju agregatnih stanja vode, koja se razlikuju po gustoći. Nakon nje pojavili su se mnogi radovi u kojima se voda razmatra kao mješavina asocijata različitog sastava (hidrola).
Kada je dvadesetih godina prošlog stoljeća utvrđena struktura leda, pokazalo se da molekule vode u kristalnom stanju tvore trodimenzionalnu kontinuiranu mrežu u kojoj svaka molekula ima četiri najbliža susjeda smještena u vrhovima pravilnog tetraedra. Godine 1933. J. Bernal i P. Fowler sugerirali su da slična mreža postoji u tekućoj vodi. Budući da je voda gušća od leda, vjerovali su da molekule u njoj nisu raspoređene kao u ledu, odnosno kao atomi silicija u mineralu tridimitu, već kao atomi silicija u gušćoj modifikaciji silicija, kvarcu. Povećanje gustoće vode pri zagrijavanju od 0 do 4C objašnjeno je prisutnošću komponente tridimita pri niskim temperaturama. Tako je model Bernala Fowlera zadržao element dvostruke strukture, ali njihovo glavno postignuće bila je ideja kontinuirane tetraedarske mreže. Tada se pojavio poznati aforizam I. Langmuira: "Okean je jedna velika molekula." Pretjerana specifikacija modela nije povećala broj pristaša teorije jedinstvene mreže.
Tek je 1951. godine J. Pople stvorio model kontinuirane mreže, koji nije bio tako specifičan kao model Bernala Fowlera. Pople je zamislio vodu kao nasumičnu tetraedarsku mrežu, veze među molekulama u kojoj su zakrivljene i imaju različite duljine. Popleov model objašnjava zbijanje vode tijekom taljenja savijanjem veza. Kada su se 60-70-ih pojavile prve definicije strukture leda II i IX, postalo je jasno kako savijanje veza može dovesti do zbijanja strukture. Popleov model nije mogao objasniti nemonotonu ovisnost svojstava vode o temperaturi i tlaku kao ni modeli s dva stanja. Stoga su ideju o dvije države dugo dijelili mnogi znanstvenici.
Ali u drugoj polovici 20. stoljeća bilo je nemoguće maštati o sastavu i strukturi hidrola kao što je to bilo početkom stoljeća. Već se znalo kako djeluju led i kristalni hidrati, a znali su i mnogo o vodikovom vezivanju. Uz modele kontinuuma (Popleov model), pojavile su se dvije skupine mješovitih modela: klasterski i klatratni. U prvoj skupini voda se pojavila u obliku nakupina molekula povezanih vodikovim vezama, koje su plutale u moru molekula koje nisu uključene u takve veze. Druga skupina modela tretirala je vodu kao kontinuiranu mrežu (koja se u ovom kontekstu obično naziva okvirom) vodikovih veza koje sadrže praznine; sadrže molekule koje ne tvore veze s molekulama okvira. Nije bilo teško odabrati svojstva i koncentracije dviju mikrofaza klaster modela ili svojstva okvira i stupanj ispunjenosti njegovih šupljina klatratnih modela kako bi se objasnila sva svojstva vode, uključujući i poznate anomalije.
Među modelima klastera najupečatljiviji je bio model G. Nemetija i H. Sheragija.: Slike koje su predložili, a koje prikazuju nakupine vezanih molekula koje plutaju u moru nevezanih molekula, uključene su u mnoge monografije.
Prvi model tipa klatrata predložio je 1946. O. Ya Samoilov: u vodi je sačuvana mreža vodikovih veza slična heksagonalnom ledu, čije su šupljine djelomično ispunjene molekulama monomera. L. Pauling je 1959. stvorio drugu opciju, sugerirajući da bi osnova strukture mogla biti mreža veza svojstvena nekim kristalnim hidratima.
Tijekom druge polovice 60-ih i početkom 70-ih godina uočena je konvergencija svih ovih pogleda. Pojavile su se varijante modela klastera u kojima su molekule u obje mikrofaze povezane vodikovim vezama. Zagovornici klatratnih modela počeli su priznavati stvaranje vodikovih veza između prazne i okvirne molekule. To jest, zapravo, autori ovih modela vodu smatraju kontinuiranom mrežom vodikovih veza. A govorimo o tome koliko je ta mreža heterogena (na primjer, po gustoći). Ideja o vodi kao klasterima vezanim vodikom koji plutaju u moru nevezanih molekula vode prekinuta je ranih osamdesetih, kada je G. Stanley primijenio teoriju perkolacije, koja opisuje fazne prijelaze vode, na vodeni model.
Godine 1999. poznati ruski istraživač vode S.V. Zenin je obranio doktorsku disertaciju na Institutu za medicinske i biološke probleme Ruske akademije znanosti o teoriji klastera, što je bio značajan korak u napretku ovog područja istraživanja čijoj složenosti doprinosi činjenica da su nalaze se na sjecištu triju znanosti: fizike, kemije i biologije. Na temelju podataka dobivenih trima fizikalno-kemijskim metodama: refraktometrijom (S.V. Zenin, B.V. Tyaglov, 1994), tekućinskom kromatografijom visoke učinkovitosti (S.V. Zenin i sur., 1998) i protonskom magnetskom rezonancijom (C S.V. Zenin, 1993) konstruiran je i dokazan geometrijski model glavne stabilne strukturne formacije molekula vode (strukturirana voda), a zatim (S.V. Zenin, 2004.) dobivena je slika tih struktura pomoću kontrastno-faznog mikroskopa.
 Znanost je sada dokazala da osobitosti fizičkih svojstava vode i brojne kratkotrajne vodikove veze između susjednih atoma vodika i kisika u molekuli vode stvaraju povoljne mogućnosti za stvaranje posebnih povezanih struktura (klastera) koje percipiraju, pohranjuju i prenose širok izbor informacija.
Znanost je sada dokazala da osobitosti fizičkih svojstava vode i brojne kratkotrajne vodikove veze između susjednih atoma vodika i kisika u molekuli vode stvaraju povoljne mogućnosti za stvaranje posebnih povezanih struktura (klastera) koje percipiraju, pohranjuju i prenose širok izbor informacija.
Strukturna jedinica takve vode je klaster koji se sastoji od klatrata, čija je priroda određena Coulombovim silama dugog dometa. Struktura klastera kodira informacije o interakcijama koje su se dogodile s tim molekulama vode. U klasterima vode, zbog interakcije između kovalentnih i vodikovih veza između atoma kisika i atoma vodika, migracija protona (H+) može se dogoditi putem relejnog mehanizma, što dovodi do delokalizacije protona unutar klastera.
Voda, koja se sastoji od mnogih klastera različitih vrsta, tvori hijerarhijsku prostornu strukturu tekućeg kristala koja može percipirati i pohraniti ogromne količine informacija.
Slika (V.L. Voeikov) prikazuje dijagrame nekoliko jednostavnih struktura klastera kao primjer.
Neke moguće strukture vodenih klastera

Fizička polja vrlo različite prirode mogu biti nositelji informacija. Time je utvrđena mogućnost daljinske informacijske interakcije tekuće kristalne strukture vode s objektima različite prirode pomoću elektromagnetskih, akustičnih i drugih polja. Objekt utjecaja može biti i osoba.
Voda je izvor ultraslabog i slabog izmjeničnog elektromagnetskog zračenja. Najmanje kaotično elektromagnetsko zračenje stvara strukturirana voda. U tom slučaju može doći do indukcije odgovarajućeg elektromagnetskog polja, mijenjajući strukturne i informacijske karakteristike bioloških objekata.
Posljednjih godina dobiveni su važni podaci o svojstvima prehlađene vode. Proučavanje vode na niskim temperaturama vrlo je zanimljivo, jer se ona može prehladiti više nego druge tekućine. Kristalizacija vode, u pravilu, počinje na nekim nehomogenostima bilo na stijenkama posude ili na plutajućim česticama čvrstih nečistoća. Stoga nije lako pronaći temperaturu na kojoj bi se prehlađena voda spontano kristalizirala. Ali znanstvenici su to uspjeli i sada je poznata temperatura takozvane homogene nukleacije, kada se formiranje kristala leda događa istovremeno u cijelom volumenu, za tlakove do 0,3 GPa, odnosno pokriva područja postojanja led II.
Od atmosferskog tlaka do granice koja razdvaja led I i II, ova temperatura pada s 231 na 180 K, a zatim blago raste na 190 K. Ispod ove kritične temperature tekuća voda je načelno nemoguća.
Struktura leda (slika desno)
 Međutim, postoji misterij povezan s ovom temperaturom. Sredinom osamdesetih godina otkrivena je nova modifikacija amorfnog leda - led visoke gustoće, što je pomoglo oživljavanju ideje o vodi kao mješavini dva stanja. Kao prototipovi nisu smatrane kristalne strukture, već strukture amorfnog leda različite gustoće. Ovaj koncept su u najjasnijem obliku formulirali E.G. Ponyatovsky i V.V. Sinitsin, koji su 1999. godine napisali: „Voda se smatra redovitom otopinom dviju komponenti, lokalne konfiguracije u kojima odgovaraju poretku modifikacija amorfnog leda kratkog dometa. .” Štoviše, proučavajući poredak kratkog dometa u prehlađenoj vodi pri visokom tlaku koristeći metode difrakcije neutrona, znanstvenici su uspjeli pronaći komponente koje odgovaraju ovim strukturama.
Međutim, postoji misterij povezan s ovom temperaturom. Sredinom osamdesetih godina otkrivena je nova modifikacija amorfnog leda - led visoke gustoće, što je pomoglo oživljavanju ideje o vodi kao mješavini dva stanja. Kao prototipovi nisu smatrane kristalne strukture, već strukture amorfnog leda različite gustoće. Ovaj koncept su u najjasnijem obliku formulirali E.G. Ponyatovsky i V.V. Sinitsin, koji su 1999. godine napisali: „Voda se smatra redovitom otopinom dviju komponenti, lokalne konfiguracije u kojima odgovaraju poretku modifikacija amorfnog leda kratkog dometa. .” Štoviše, proučavajući poredak kratkog dometa u prehlađenoj vodi pri visokom tlaku koristeći metode difrakcije neutrona, znanstvenici su uspjeli pronaći komponente koje odgovaraju ovim strukturama.
Posljedica polimorfizma amorfnog leda također je dovela do pretpostavki o razdvajanju vode u dvije komponente koje se ne miješaju na temperaturama ispod hipotetske niskotemperaturne kritične točke. Nažalost, prema istraživačima, ova temperatura pri tlaku od 0,017 GPa je 230 K ispod temperature nukleacije, tako da nitko još nije uspio promatrati stratifikaciju tekuće vode. Stoga je oživljavanje modela dvaju stanja otvorilo pitanje heterogenosti mreže vodikovih veza u tekućoj vodi. Ova se heterogenost može razumjeti samo pomoću računalnog modeliranja.
Govoreći o kristalnoj strukturi vode, treba napomenuti da je poznato 14 modifikacija leda, od kojih većina nije pronađena u prirodi, u kojoj molekule vode zadržavaju svoju individualnost i povezane su vodikovim vezama. S druge strane, postoje mnoge varijante mreže vodikovih veza u klatratnim hidratima. Energije ovih mreža (visokotlačni led i klatratni hidrati) nisu puno veće od energija kubičnog i heksagonalnog leda. Stoga se fragmenti takvih struktura mogu pojaviti iu tekućoj vodi. Moguće je konstruirati bezbroj različitih neperiodičnih fragmenata, čije molekule imaju četiri najbliža susjeda smještena približno na vrhovima tetraedra, ali njihova struktura ne odgovara strukturama poznatih modifikacija leda. Kao što su pokazali brojni izračuni, energije interakcije molekula u takvim fragmentima bit će blizu jedna drugoj i nema razloga reći da bi bilo kakva struktura trebala prevladati u tekućoj vodi.
Strukturne studije vode mogu se proučavati različitim metodama; spektroskopija protonske magnetske rezonancije, infracrvena spektroskopija, difrakcija X-zraka itd. Na primjer, difrakcija X-zraka i neutrona proučavana je mnogo puta. Međutim, ovi eksperimenti ne mogu pružiti detaljne informacije o strukturi. Nehomogenosti koje se razlikuju po gustoći mogu se vidjeti raspršivanjem X-zraka i neutrona pod malim kutovima, ali takve nehomogenosti moraju biti velike, sastoje se od stotina molekula vode. Bilo bi ih moguće vidjeti proučavanjem raspršenja svjetlosti. Međutim, voda je iznimno bistra tekućina. Jedini rezultat difrakcijskih pokusa je funkcija radijalne distribucije, odnosno udaljenost između atoma kisika, vodika i kisik-vodika. Iz njih je jasno da ne postoji dalekosežni red u rasporedu molekula vode. Ove funkcije propadaju mnogo brže za vodu nego za većinu drugih tekućina. Na primjer, raspodjela udaljenosti između atoma kisika na temperaturama bliskim sobnoj daje samo tri maksimuma, na 2,8, 4,5 i 6,7. Prvi maksimum odgovara udaljenosti do najbližih susjeda, a njegova je vrijednost približno jednaka duljini vodikove veze. Drugi maksimum blizu je prosječne duljine ruba tetraedra: zapamtite da su molekule vode u heksagonalnom ledu smještene duž vrhova tetraedra opisanog oko središnje molekule. A treći maksimum, vrlo slabo izražen, odgovara udaljenosti do trećih i daljih susjeda u mreži vodika. Ovaj maksimum sam po sebi nije baš sjajan, a o daljnjim vrhuncima ne treba govoriti. Bilo je pokušaja da se iz tih distribucija dobiju detaljnije informacije. Tako su 1969. I. S. Andrianov i I. Z. Fisher pronašli udaljenosti do osmog susjeda, dok je do petog susjeda ispalo 3, a do šestog 3,1. To omogućuje dobivanje podataka o udaljenom okruženju molekula vode.
Druga metoda proučavanja strukture - difrakcija neutrona na kristalima vode - provodi se na potpuno isti način kao i difrakcija rendgenskih zraka. Međutim, zbog činjenice da se duljine raspršenja neutrona ne razlikuju toliko između različitih atoma, metoda izomorfne supstitucije postaje neprihvatljiva. U praksi se obično radi s kristalom čija je molekularna struktura već približno određena drugim metodama. Zatim se za ovaj kristal mjere intenziteti difrakcije neutrona. Na temelju tih rezultata provodi se Fourierova transformacija tijekom koje se koriste izmjereni intenziteti i faze neutrona, izračunati uzimajući u obzir nevodikove atome, tj. atomi kisika, čiji je položaj u modelu strukture poznat. Tada su na tako dobivenoj Fourierovoj karti atomi vodika i deuterija prikazani puno većim težinama nego na karti gustoće elektrona, jer doprinos ovih atoma raspršenju neutrona je vrlo velik. Pomoću ove karte gustoće možete, primjerice, odrediti položaje atoma vodika (negativna gustoća) i deuterija (pozitivna gustoća).
Moguća je varijacija ove metode koja se sastoji u tome da se kristal formiran u vodi prije mjerenja drži u teškoj vodi. U ovom slučaju neutronska difrakcija ne samo da omogućuje određivanje gdje se nalaze atomi vodika, već također identificira one od njih koji se mogu zamijeniti za deuterij, što je posebno važno pri proučavanju izmjene izotopa (H-D). Takve informacije pomažu potvrditi da je struktura ispravno postavljena.
Druge metode također omogućuju proučavanje dinamike molekula vode. Riječ je o eksperimentima kvazielastičnog raspršenja neutrona, ultrabrze IR spektroskopije i proučavanja difuzije vode pomoću NMR-a ili obilježenih atoma deuterija. Metoda NMR spektroskopije temelji se na činjenici da jezgra atoma vodika ima magnetski moment - spin - koji je u interakciji s magnetskim poljima, konstantnim i promjenjivim. Iz NMR spektra može se prosuditi u kakvoj se okolini nalaze ti atomi i jezgre, čime se dobiva informacija o strukturi molekule.
Kao rezultat pokusa kvazielastičnog raspršenja neutrona u kristalima vode izmjeren je najvažniji parametar - koeficijent samodifuzije pri različitim tlakovima i temperaturama. Da bi se procijenio koeficijent samodifuzije iz kvazielastičnog raspršenja neutrona, potrebno je napraviti pretpostavku o prirodi molekularnog gibanja. Ako se kreću u skladu s modelom Ya.I. Frenkela (poznatog ruskog teorijskog fizičara, autora “Kinetičke teorije tekućina” - klasične knjige prevedene na mnoge jezike), koji se naziva i model “čekanja skoka”, tada je vrijeme ustaljenog života (vrijeme između skakanja) molekule 3,2 pikosekunde. Najnovije metode femtosekundne laserske spektroskopije omogućile su procjenu životnog vijeka prekinute vodikove veze: protonu je potrebno 200 fs da nađe partnera. Međutim, sve su to prosječne vrijednosti. Moguće je proučavati detalje strukture i prirode kretanja molekula vode samo uz pomoć računalne simulacije, koja se ponekad naziva i numerički eksperiment.

Ovako izgleda struktura vode prema rezultatima računalnog modeliranja (prema doktoru kemijskih znanosti G.G. Malenkovu). Opća nesređena struktura može se podijeliti u dvije vrste područja (prikazanih kao tamne i svijetle lopte), koje se razlikuju po svojoj strukturi, na primjer, po volumenu Voronoijevog poliedra (a), stupnju tetraedralnosti neposrednog okruženja ( b), vrijednost potencijalne energije (c), kao i prisutnost četiri vodikove veze u svakoj molekuli (d). Međutim, ta će područja doslovno u trenutku, nakon nekoliko pikosekundi, promijeniti svoj položaj.
Simulacija se izvodi ovako. Ledena struktura se uzima i zagrijava dok se ne otopi. Zatim, nakon nekog vremena da voda zaboravi na svoje kristalno podrijetlo, snimaju se trenutne mikrofotografije.
Za analizu strukture vode odabrana su tri parametra:
- stupanj odstupanja lokalnog okruženja molekule od vrhova pravilnog tetraedra;
-potencijalna energija molekula;
-volumen tzv. Voronoijevog poliedra.
Da biste konstruirali ovaj poliedar, uzmite rub od dane molekule do najbliže, podijelite ga na pola i nacrtajte ravninu kroz tu točku okomito na rub. To daje volumen po molekuli. Volumen poliedra je gustoća, tetraedralnost je stupanj iskrivljenja vodikovih veza, energija je stupanj stabilnosti molekulske konfiguracije. Molekule sa sličnim vrijednostima svakog od ovih parametara nastoje se grupirati u zasebne klastere. I područja niske i visoke gustoće imaju različite energetske vrijednosti, ali mogu imati i iste energetske vrijednosti. Eksperimenti su pokazali da područja s različitim strukturama, klasteri nastaju spontano i spontano se raspadaju. Cjelokupna struktura vode je živa i stalno se mijenja, a vrijeme u kojem se te promjene događaju je vrlo kratko. Istraživači su pratili kretanje molekula i otkrili da izvode nepravilne vibracije s frekvencijom od oko 0,5 ps i amplitudom od 1 angstroma. Također su primijećeni rijetki spori skokovi angstrema koji traju pikosekunde. Općenito, za 30 ps molekula se može pomaknuti 8-10 angstrema. Životni vijek lokalne sredine također je kratak. Regije sastavljene od molekula sa sličnim volumenskim vrijednostima Voronoijevog poliedra mogu se raspasti za 0,5 ps, ili mogu živjeti nekoliko pikosekundi. Ali distribucija vremena života vodikovih veza je vrlo velika. Ali ovo vrijeme ne prelazi 40 ps, a prosječna vrijednost je nekoliko ps.
Zaključno treba naglasiti da Teorija klaster strukture vode ima mnogo zamki. Na primjer, Zenin sugerira da je glavni strukturni element vode skup od 57 molekula nastalih spajanjem četiri dodekaedra. Imaju zajednička lica, a njihova središta čine pravilan tetraedar. Odavno je poznato da se molekule vode mogu nalaziti na vrhovima peterokutnog dodekaedra; Takav dodekaedar je osnova plinskih hidrata. Stoga nema ničeg iznenađujućeg u pretpostavci o postojanju takvih struktura u vodi, iako je već rečeno da niti jedna specifična struktura ne može biti dominantna i postojati dugo vremena. Stoga je čudno da se ovaj element smatra glavnim i da sadrži točno 57 molekula. Od kuglica, na primjer, možete sastaviti iste strukture, koje se sastoje od dodekaedra koji se nalaze jedan uz drugi i sadrže 200 molekula. Zenin tvrdi da se proces trodimenzionalne polimerizacije vode zaustavlja na 57 molekula. Prema njegovom mišljenju, ne bi trebalo biti većih suradnika. Međutim, kad bi to bilo tako, heksagonalni kristali leda, koji sadrže ogroman broj molekula međusobno povezanih vodikovim vezama, ne bi se mogli istaložiti iz vodene pare. Uopće nije jasno zašto se rast Zenin klastera zaustavio na 57 molekula. Kako bi izbjegao proturječja, Zenin pakira klastere u složenije formacije - romboedre - od gotovo tisuću molekula, a originalni klasteri međusobno ne tvore vodikove veze. Zašto? Kako se molekule na njihovoj površini razlikuju od onih unutra? Prema Zeninu, uzorak hidroksilnih skupina na površini romboedra osigurava pamćenje vode. Posljedično, molekule vode u ovim velikim kompleksima su čvrsto fiksirane, a sami kompleksi su krutine. Takva voda neće teći, a njezino talište, koje je povezano s molekularnom težinom, mora biti vrlo visoko.
Koja svojstva vode objašnjava Zeninov model? Budući da se model temelji na tetraedarskim strukturama, može biti više ili manje konzistentan s podacima rendgenske difrakcije i neutronske difrakcije. Međutim, malo je vjerojatno da model može objasniti smanjenje gustoće tijekom topljenja; pakiranje dodekaedra manje je gusto od leda. Ali najteže se složiti s modelom s dinamičkim svojstvima - fluidnošću, velikom vrijednošću koeficijenta samodifuzije, kratkim korelacijskim i dielektričnim vremenima relaksacije, koja se mjere u pikosekundama.
dr.sc. O.V. Mosin
Reference:
G.G. Maljenkov. Napredak u fizikalnoj kemiji, 2001
S.V.Zenin, B.M. Polanuer, B.V. Tjaglov. Eksperimentalni dokaz prisutnosti frakcija vode. G. Homeopatski lijekovi i akupunktura. 1997.br.2.str.42-46.
S.V. Zenin, B.V. Tjaglov. Hidrofobni model strukture asocijata molekula vode. J. Physical Chemistry, 1994. T. 68. No. 4. P. 636-641.
S.V. Zenin Proučavanje strukture vode metodom protonske magnetske rezonancije. Dokl.RAN.1993.T.332.br.3.S.328-329.
S.V.Zenin, B.V.Tyaglov. Priroda hidrofobne interakcije. Pojava orijentacijskih polja u vodenim otopinama. J. Fizička kemija 1994. T. 68. Broj 3. P. 500-503.
S.V. Zenin, B.V. Tyaglov, G.B. Sergeev, Z.A. Šabarova. Proučavanje intramolekularnih interakcija u nukleotidamidima pomoću NMR-a. Materijali 2. svesavezne konf. Po dinamici Stereokemija. Odessa.1975.str.53.
S.V. Zenin. Strukturirano stanje vode kao osnova za kontrolu ponašanja i sigurnosti živih sustava. diplomski rad. Doktor bioloških znanosti. Državni znanstveni centar "Institut za medicinske i biološke probleme" (SSC "IMBP"). Zaštićeno 1999. 05. 27. UDK 577.32:57.089.001.66.207 str.
U I. Slesarev. Izvješće o napretku istraživanja
Tambovsko državno sveučilište nazvano po. GR. Deržavina
Soros Educational Journal, svezak 6, br. 9, 2000
Voda i led: znamo li dovoljno o njima?
Yu. I. GOLOVIN
Opisana su fizikalna svojstva vode i leda. Raspravljaju se mehanizmi raznih pojava u ovim tvarima. Unatoč dugom razdoblju proučavanja i jednostavnom kemijskom sastavu, voda i led – tvari vrlo vrijedne za život na zemlji – kriju mnoge misterije zbog svoje komplicirane dinamičke protonske i molekularne strukture.Dan je kratak pregled fizikalnih svojstava vode i leda. Razmatraju se mehanizmi raznih pojava u njima. Pokazalo se da je, unatoč višestoljetnoj povijesti proučavanja, najjednostavnijem kemijskom sastavu i iznimnoj važnosti za život na Zemlji, priroda vode i leda zbog složene dinamičke protonske i molekularne strukture prepuna mnogih misterija.
Iako ljudima više treba jednostavnost,
Ipak, kompleks im je jasniji.
B.L. Pastrnjak
Možda nema raširenije, a ujedno i tajanstvenije tvari na Zemlji od vode u tekućem i čvrstom stanju. Doista, dovoljno je prisjetiti se da sva živa bića potječu iz vode i da se sastoji od više od 50% vode, da je 71% Zemljine površine prekriveno vodom i ledom, a značajan dio sjevernog kopna čini permafrost. Kako bismo vizualizirali ukupnu količinu leda na našem planetu, napominjemo da će se, ako se otopi, voda u Svjetskom oceanu podići za više od 50 m, što će dovesti do poplave gigantskih kopnenih površina diljem svijeta. U Svemiru, uključujući i Sunčev sustav, otkrivene su ogromne mase leda. Ne postoji niti jedna manje ili više značajna proizvodnja ili ljudska djelatnost u kojoj se voda ne koristi. Posljednjih desetljeća otkrivene su velike rezerve goriva u obliku čvrstih ledolikih hidrata prirodnih ugljikovodika.
Istodobno, nakon brojnih uspjeha u fizici i fizikalnoj kemiji vode posljednjih godina, teško se može tvrditi da su svojstva ove jednostavne tvari potpuno razumljiva i predvidljiva. Ovaj članak daje kratak pregled najvažnijih fizikalnih svojstava vode i leda i neriješenih problema koji se uglavnom odnose na fiziku njihovih niskotemperaturnih stanja.
Ovo je komplicirana molekula
Temelje suvremenog razumijevanja fizikalne kemije vode postavili su prije otprilike 200 godina Henry Cavendish i Antoine Lavoisier, koji su otkrili da voda nije jednostavan kemijski element, kako su vjerovali srednjovjekovni alkemičari, već spoj kisika i vodika u određeni omjer. Zapravo, vodik (hidrogen) - koji rađa vodu - dobio je svoje ime tek nakon ovog otkrića, a voda je dobila svoju modernu kemijsku oznaku, sada poznatu svakom školarcu - H 2 O.
Dakle, molekula H 2 O građena je od dva atoma vodika i jednog atoma kisika. Kao što je utvrđeno studijama optičkih spektara vode, u hipotetskom stanju potpune odsutnosti kretanja (bez oscilacija i rotacija), ioni vodika i kisika trebali bi zauzimati položaje na vrhovima jednakokračnog trokuta s kutom na vrhu koji zauzima kisik. od 104,5° (slika 1, a). U nepobuđenom stanju udaljenosti između iona H + i O 2− iznose 0,96 Å. Zahvaljujući ovakvoj strukturi molekula vode je dipol, budući da je gustoća elektrona u području gdje se nalazi O 2− ion znatno veća nego u području H + iona, a najjednostavniji model - model sfera - je slabo prikladan za opisivanje svojstava vode. Možete zamisliti molekulu vode u obliku lopte s dva mala oteklina u području gdje se nalaze protoni (slika 1, b). Međutim, to ne pomaže razumjeti još jednu značajku vode - sposobnost stvaranja usmjerenih vodikovih veza između molekula, koje igraju veliku ulogu u formiranju njezine labave, ali istodobno vrlo stabilne prostorne strukture, koja određuje većinu fizikalna svojstva u tekućem i čvrstom stanju.
Riža. 1. Geometrijski dijagram (a), ravni model (b) i prostorna elektronska struktura (c) monomera H 2 O. Dva od četiri elektrona u vanjskoj ljusci atoma kisika sudjeluju u stvaranju kovalentnih veza s atomima vodika, a druga dva tvore visoko izdužene elektronske orbite, ravnina koja je okomita na ravninu H–O–H
Podsjetimo, vodikova veza je veza između atoma u jednoj molekuli ili susjednih molekula koja nastaje preko atoma vodika. Zauzima srednji položaj između kovalentne i nevalentne veze i nastaje kada se atom vodika nalazi između dva elektronegativna atoma (O, N, F, itd.). Elektron u atomu H je relativno slabo vezan za proton, pa se maksimalna gustoća elektrona pomiče prema elektronegativnijem atomu, a proton postaje izložen i počinje djelovati s drugim elektronegativnim atomom. U ovom slučaju, atomi O⋅⋅⋅O, N⋅⋅⋅O itd. se približavaju. na udaljenost blisku onoj koja bi se između njih uspostavila u odsutnosti atoma H. Vodikova veza ne određuje samo strukturu vode, već također igra iznimno važnu ulogu u životu biomolekula: proteina, ugljikohidrata, nukleinskih kiselina itd. .
Očito, za objašnjenje prirode vode potrebno je uzeti u obzir elektroničku strukturu njezinih molekula. Kao što znate, atom kisika ima četiri elektrona u svojoj gornjoj ljusci, dok vodik ima samo jedan elektron. Stvaranje svake kovalentne O–H veze uključuje po jedan elektron iz atoma kisika i vodika. Dva elektrona koja ostaju u kisiku nazivaju se usamljeni par, budući da u izoliranoj molekuli vode ostaju slobodni, ne sudjeluju u stvaranju veza unutar molekule H 2 O. Ali kada se približavaju drugim molekulama, ti usamljeni elektroni igraju odlučujuću ulogu u formiranju molekularne strukture vode .
Usamljeni elektroni se odbijaju O–H vezama, pa su njihove orbite jako izdužene u smjeru suprotnom od vodikovih atoma, a ravnine orbita su zakrenute u odnosu na ravninu koju čine O–H–O veze. Stoga bi bilo ispravnije molekulu vode prikazati u trodimenzionalnom koordinatnom prostoru xyz u obliku tetraedra, u čijem se središtu nalazi atom kisika, a na dva vrha nalazi se atom vodika (slika 1, c). Elektronska struktura molekula H 2 O određuje uvjete za njihovo udruživanje u složenu trodimenzionalnu mrežu vodikovih veza i u vodi i u ledu. Svaki od protona može formirati vezu s usamljenim elektronom druge molekule. Prva molekula djeluje kao akceptor, a druga kao donor, tvoreći vodikovu vezu. Budući da svaka molekula H2O ima dva protona i dva usamljena elektrona, može stvoriti četiri vodikove veze s drugim molekulama u isto vrijeme. Dakle, voda je složena pridružena tekućina s dinamičkom prirodom veza, a opis njezinih svojstava na molekularnoj razini moguć je samo uz pomoć kvantno-mehaničkih modela različitog stupnja složenosti i strogosti.
Led i njegova svojstva
Sa stajališta prosječne osobe, led je više-manje isti bez obzira gdje nastaje: u atmosferi kao zrno tuče, na rubovima krovova kao ledenice ili u vodenim površinama kao ploče. S fizičkog gledišta, postoje mnoge vrste leda, koje se razlikuju po svojoj molekularnoj i mezoskopskoj strukturi. U ledu koji postoji pri normalnom tlaku svaka molekula H 2 O okružena je s četiri ostale, odnosno koordinacijski broj strukture je četiri (tzv. led I h). Odgovarajuća kristalna rešetka - heksagonalna - nije zbijeno pakirana, stoga je gustoća običnog leda (∼0,9 g/cm 3 ) niža od gustoće vode (∼1 g/cm 3), za čiju strukturu, kao Studije difrakcije rendgenskih zraka pokazuju da je prosječni koordinacijski broj ~ 4,4 (u odnosu na 4 za led I h). Samo atomi kisika zauzimaju fiksne položaje u strukturi leda. Dva atoma vodika mogu zauzeti različite položaje na četiri veze molekule H 2 O s drugim susjedima. Zbog heksagonalnosti rešetke, kristali koji rastu u slobodnom stanju (na primjer, snježne pahulje) imaju heksagonalni oblik.
Međutim, heksagonalna faza daleko je od jedinog oblika postojanja leda. Točan broj ostalih kristalnih faza – polimorfnih oblika leda – još uvijek nije poznat. Nastaju pri visokim tlakovima i niskim temperaturama (slika 2). Neki istraživači smatraju da je prisutnost 12 takvih faza točno utvrđena, dok ih drugi broje do 14. Naravno, to nije jedina tvar koja ima polimorfizam (sjetimo se, na primjer, grafita i dijamanta, koji se sastoje od kemijski identičnih atoma ugljika ), ali broj različitih faza leda, koje se nastavljaju otkrivati do danas, je nevjerojatan. Sve navedeno odnosilo se na uređen raspored iona kisika u kristalnoj rešetki leda. Što se tiče protona - vodikovih iona - kao što je pokazala difrakcija neutrona, postoji veliki nered u njihovom rasporedu. Dakle, kristalni led je i dobro uređen medij (u odnosu na kisik) i istovremeno neuređen medij (u odnosu na vodik).

Riža. 2. Fazni dijagram kristalnog leda.
Rimski brojevi označavaju područja postojanja
stvaranje stabilnih faza. Led IV je metastabilna fa-
za, koji se nalazi na dijagramu unutar područja V
Često se čini da je led savitljiv i tečan. To vrijedi ako je temperatura blizu tališta (tj. t = 0°C pri atmosferskom tlaku), a opterećenje se primjenjuje dugo vremena. I najtvrđi materijal (primjerice metal) na temperaturama blizu tališta ponaša se na sličan način. Plastična deformacija leda, kao i mnogih drugih kristalnih krutina, događa se kao rezultat nukleacije i kretanja različitih strukturnih nesavršenosti kroz kristal: praznine, intersticijski atomi, granice zrna i, najvažnije, dislokacije. Kao što je utvrđeno još 30-ih godina našeg stoljeća, prisutnost potonjeg unaprijed određuje naglo smanjenje otpornosti kristalnih krutina na plastičnu deformaciju (za 10 2 –10 4 puta u odnosu na otpornost idealne rešetke). Do danas su u ledu Ih otkrivene sve vrste dislokacija karakteristične za heksagonalnu strukturu te su proučavane njihove mikromehaničke i električne karakteristike.
Učinak brzine deformacije na mehanička svojstva monokristalnog leda dobro je ilustriran na sl. 3, preuzeto iz knjige N. Maeno. Vidi se da s povećanjem brzine deformacije mehanička naprezanja σ potrebna za plastično tečenje brzo rastu i pojavljuje se golemi zub popuštanja na ovisnosti relativne deformacije E o σ.

Riža. 3.(autor). Krivulje deformacije u odnosu na naprezanje za monokristal leda I h pri t = −15°S (klizanje duž bazalne ravnine orijentirane pod kutom od 45° u odnosu na os kompresije). Brojevi na krivuljama označavaju relativnu brzinu deformacije ( ∆l– promjena duljine uzorka l tijekom ∆τ
) u jedinicama od 10 −7 s −1

Riža. 4. Shema nastanka defekata u protonskom podsustavu leda: a – par ionskih defekata H 3 O + i OH –; b – par orijentacijskih Bjerrumovih defekata D i L
Električna svojstva leda nisu ništa manje izvanredna. Veličina vodljivosti i njezino eksponencijalno brzo povećanje s povećanjem temperature oštro razlikuju led od metalnih vodiča i stavljaju ga u rang s poluvodičima. Led je obično vrlo kemijski čist, čak i ako raste iz prljave vode ili otopine (zamislite čiste, prozirne komade leda u prljavoj lokvi). To je zbog niske topljivosti nečistoća u strukturi leda. Kao rezultat toga, tijekom smrzavanja, nečistoće se potiskuju na fronti kristalizacije u tekućinu i ne ulaze u strukturu leda. Zato je svježe napadali snijeg uvijek bijel, a voda iz njega iznimno čista.
Priroda je mudro osigurala ogromnu stanicu za pročišćavanje vode u Zemljinoj atmosferi. Stoga se u ledu ne može računati na visoku vodljivost nečistoća (kao, na primjer, u dopiranom siliciju). Ali u njemu nema slobodnih elektrona, kao u metalima. Tek 50-ih godina 20. stoljeća utvrđeno je da su nositelji naboja u ledu neuređeni protoni, odnosno da je led protonski poluvodič.
Gore spomenuto skakanje protona stvara dvije vrste defekata u strukturi leda: ionske i orijentacijske (slika 4). U prvom slučaju dolazi do skoka protona duž vodikove veze s jedne molekule H 2 O na drugu (slika 4, a), što rezultira stvaranjem para ionskih defekata H 3 O + i OH -, au drugi - na susjednu vodikovu vezu u jednoj molekuli H 2 O (slika 4, b), zbog čega nastaje par orijentacijskih Bjerrumovih defekata, nazvanih L i D-defekti (od njemačkog leer - prazan i doppelt - dvostruki ). Formalno se takav skok može smatrati rotacijom molekule H 2 O za 120°.
Protjecanje istosmjerne struje zbog kretanja samo ionskih ili samo orijentacijskih defekata je nemoguće. Ako, na primjer, ion H 3 O + prođe kroz neki dio rešetke, tada sljedeći sličan ion neće moći proći istim putem. Međutim, ako se D-defekt prođe duž ovog puta, raspored protona će se vratiti na prvobitni i stoga će sljedeći ion H 3 O + moći proći. Slično se ponašaju i defekti OH - i L. Stoga je električna vodljivost kemijski čistog leda ograničena onim defektima kojih ima manje, a to su ionski. Dielektrična polarizacija, naprotiv, posljedica je brojnijih orijentacijskih Bjerrumovih defekata. Zapravo, kada se primijeni vanjsko električno polje, oba se procesa odvijaju paralelno, što omogućuje ledu da provodi istosmjernu struju i da istovremeno doživi jaku dielektričnu polarizaciju, odnosno da pokazuje i svojstva poluvodiča i svojstva izolator. Posljednjih godina nastavljeni su pokušaji otkrivanja feroelektričnih i piezoelektričnih svojstava čistog leda pri niskim temperaturama, kako u masi tako i na međufaznim granicama. Još uvijek nema potpunog povjerenja u njihovo postojanje, iako je otkriveno nekoliko pseudo-piezoelektričnih učinaka povezanih s prisutnošću dislokacija i drugih strukturnih defekata.
Fizika površine i kristalizacija leda
U vezi s razvojem tehnologije poluvodiča, mikrominijaturizacijom elementarne baze i prijelazom na planarne tehnologije, interes za fiziku površina u posljednjem se desetljeću znatno povećao. Razvijene su mnoge sofisticirane tehnike za proučavanje stanja blizu površine u čvrstim tijelima, koje su se pokazale korisnima u proučavanju metala, poluvodiča i dielektrika. Međutim, struktura i svojstva površine leda u blizini pare ili tekućine ostaju uglavnom nejasni. Jedna od najintrigantnijih hipoteza, koju je iznio M. Faraday, jest postojanje kvazi-tekućeg sloja na površini leda debljine nekoliko desetaka do stotina angstrema, čak i na temperaturi daleko ispod točke taljenja. Osnova za to nisu samo spekulativne konstrukcije i teorije o strukturi pripovršinskih slojeva visoko polariziranih molekula H 2 O, već i suptilna određivanja (pomoću nuklearne magnetske rezonancije) faznog stanja površine leda, kao i njegove vodljivost površine i njezina ovisnost o temperaturi. Međutim, u većini praktičnih važnih slučajeva, površinska svojstva snijega i leda najvjerojatnije su određena prisutnošću makroskopskog filma vode, a ne kvazi-tekućeg sloja.
Otapanje površinskih slojeva leda pod utjecajem sunčeve svjetlosti, toplije atmosfere ili čvrstog tijela koje klizi po njoj (klizaljke, skije, sanjke) ključno je za postizanje niskog koeficijenta trenja. Nisko trenje klizanja nije posljedica sniženja temperature taljenja pod utjecajem povećanog tlaka, kako se često misli, već posljedica oslobađanja topline trenja. Proračuni pokazuju da učinak tlaka, čak i u slučaju klizanja oštro naoštrene klizaljke po ledu, pri čemu se razvija tlak od oko 1 MPa, dovodi do smanjenja temperature taljenja za samo ~0,1°C, što ne može imati značajan utjecaj na količinu trenja.
Uspostavljena tradicija u opisivanju svojstava vode i leda je izjava i rasprava o mnogim anomalnim svojstvima koja razlikuju ovu tvar među svojim homolozima (H 2 S, H 2 Se, H 2 Te). Možda je najvažniji vrlo visok (među jednostavnim tvarima) specifična toplina taljenja (kristalizacije) i toplinski kapacitet, odnosno led se teško otapa, a voda se teško smrzava. Kao rezultat toga, klima na našem planetu općenito je prilično blaga, ali u nedostatku vode (na primjer, u pustinjama vruće Afrike), kontrast između dnevne i noćne temperature je puno veći nego na obali oceana u isto vrijeme. zemljopisna širina. Za biosferu je bitno svojstvo povećanja volumena tijekom kristalizacije, a ne smanjenja, kao što to čini velika većina poznatih tvari. Kao rezultat toga, led pluta u vodi umjesto da tone i uvelike usporava smrzavanje vodenih tijela u hladnom vremenu, štiteći sva živa bića koja se u njemu sklone za zimu. Tome također pridonosi nemonotona promjena gustoće vode kada temperatura padne na 0°C – jedno od najpoznatijih anomalnih svojstava vode, otkriveno prije više od 300 godina. Najveća gustoća se postiže pri t = 4°C, čime se sprječava da pripovršinski slojevi vode koji su se ohladili na temperaturu ispod 4°C potone na dno. Konvekcijsko miješanje tekućine je blokirano, što uvelike usporava daljnje hlađenje. Druge anomalije vode poznate su dosta dugo: smična viskoznost na 20°C, specifična toplina na 40°C, izotermna kompresibilnost na 46°C, brzina zvuka na 60°C. Viskoznost vode opada s povećanjem tlaka, a ne raste, kao kod drugih tekućina. Jasno je da su anomalna svojstva vode posljedica strukturnih značajki njezine molekule i specifičnosti međumolekulskih interakcija. Potpuna jasnoća u vezi s potonjim još nije postignuta. Gore opisana svojstva odnose se na vodu, led i sučelje između njih, koji postoje u uvjetima termodinamičke ravnoteže. Problemi sasvim druge razine složenosti javljaju se kada se pokušava opisati dinamika faznog prijelaza voda–led, posebno u uvjetima daleko od termodinamičke ravnoteže.
Termodinamički uzrok svakog faznog prijelaza je razlika u kemijskim potencijalima čestica s jedne i druge strane sučelja ∆µ = µ 1 −µ 2. Kemijski potencijal µ je funkcija stanja koja određuje promjene termodinamičkih potencijala kada se mijenja broj N čestica u sustavu, odnosno µ = G/N, gdje je G = H − TS Gibbsov termodinamički potencijal, H je entalpija, S je entropija, T je temperatura. Razlika termodinamičkih potencijala pokretačka je sila makroskopskog procesa (kao što je razlika električnih potencijala na krajevima vodiča uzrok električne struje). Pri µ1 = µ2 obje faze mogu koegzistirati u ravnoteži koliko god dugo žele. Pri normalnom tlaku kemijski potencijal vode jednak je kemijskom potencijalu leda pri t = 0°C. Na t< 0°С более низким химическим потенциалом обладает лед, но это еще не означает, что при любом, самом маленьком переохлаждении начнется кристаллизация. Опыт показывает, что тщательно очищенный от примесей, обезгаженный, деионизированный расплав может быть переохлажден относительно точки равновесия фаз на десятки кельвин (а для некоторых веществ и на сотни). Анализ показывает, что причина заключается в отсутствии зародышей новой фазы (центров кристаллизации, конденсации, парообразования и т.д.).
Embriji se mogu formirati i homogeno, odnosno iz same okoline koja je u metastabilnom stanju, ali za to moraju biti ispunjeni određeni uvjeti. Započnimo razmatrati situaciju uzimajući u obzir činjenicu da svako sučelje između kristala i taline (ili pare, otopine) unosi dodatnu energiju Sα, gdje je S granično područje, α površinska energija. Osim toga, molekule N koje su formirale klice imaju energiju nižu nego u tekućini za N∆µ. Kao rezultat toga, ukupna promjena energije u sustavu nakon pojave jezgre ∆U = −N∆µ + Sα pokazat će se da nije monotono ovisna o N. Doista, za sferni oblik jezgre
![]()
gdje je A = (36πV 2) 1/3 V volumen po jednoj molekuli u kristalu. Iz prethodnog slijedi da ∆U doseže maksimum ∆Uc = - N c ∆µ + AN c 2/3 α, kada jezgra sadrži N c = (2Aα/3∆µ) 3 molekule.
Dakle, sekvencijalnim dodavanjem molekula u jezgru, sustav se prvo mora popeti na vrh potencijalnog brežuljka visine ∆U c, ovisno o superhlađenju, nakon čega će doći do daljnjeg rasta N u kristalu uz smanjenje energije, odnosno lakše. Čini se da bi kristalizacija trebala biti brža što je temperatura tekućine niža, odnosno što je jače prehlađenje. To je zapravo slučaj kada hipotermija nije prevelika. Međutim, kako se t smanjuje, viskoznost tekućine također eksponencijalno raste, što otežava kretanje molekula. Kao rezultat toga, pri visokim stupnjevima superhlađenja, proces kristalizacije može se povući godinama (kao što je slučaj sa staklima različitog podrijetla).
Numeričke procjene pokazuju da bi se za vodu pri normalnim stupnjevima prehlađenja u prirodnim uvjetima (∆t = 1–10°C) embrij trebao sastojati od nekoliko desetaka molekula, što je znatno više od koordinacijskog broja u tekućoj fazi (~4,4 ). Dakle, sustav zahtijeva veliki broj pokušaja fluktuacije da se popne na vrh energetskog brda. U ne baš temeljito pročišćenoj vodi, jako prehlađenje je spriječeno prisutnošću već postojećih centara kristalizacije, a to mogu biti čestice nečistoće, čestice prašine, neravnine stijenki posude itd. Naknadno, kinetika rasta kristala ovisi o uvjetima prijenosa topline u blizini međufazne granice, kao i na morfologiju potonje na atomskoj razini.molekulskoj razini.
Jako prehlađena voda ima dvije karakteristične temperature t h = −36°C i t g = −140°C. Dobro pročišćena i otplinjena voda u temperaturnom području 0°S > t > t h može dugo ostati u stanju prehlađene tekućine. U t g< t < t h происходит гомогенное зарождение кристалликов льда, и вода не может находиться в переохлажденном состоянии при любой степени очистки. В условиях достаточно быстрого охлаждения при t < tg подвижность молекул воды настолько падает (а вязкость растет), что она образует стеклообразное твердое тело с аморфной структурой, свойственной жидкостям. При этом в области невысоких давлений образуется аморфная фаза низкой плотности, а в области повышенных – аморфная фаза высокой плотности, то есть вода демонстрирует полиаморфизм. При изменениях давления или температуры одна аморфная фаза скачком переходит в другую с неожиданно большим изменением плотности (>20%).
Postoji nekoliko stajališta o prirodi poliamorfizma vode. Dakle, prema , ovakvo ponašanje jako prehlađene vode može se objasniti ako prihvatimo da u potencijalnom profilu međudjelovanja dviju molekula H2O postoji više od jednog minimuma,

Riža. 5(autor). Hipotetski profili potencijala: a – s jednim energetskim minimumom (npr. Lennard-Jonesov potencijal U(r) = A/r 6 − B/r 12) i b – s dva energetska minimuma, koji odgovaraju dvjema stabilnim konfiguracijama skup dviju molekula vode (1 i 2) koje međusobno djeluju s različitim udaljenostima između uvjetnih središta molekula r H i r L; prvi od njih odgovara fazi s većom gustoćom, drugi - s nižom
i dva (slika 5). Tada će amorfna faza visoke gustoće odgovarati prosječnoj udaljenosti rH, a faza niske gustoće – rL. Računalno modeliranje potvrđuje ovu točku gledišta, ali još nema pouzdanih eksperimentalnih dokaza za ovu hipotezu, niti postoji rigorozna teorija koja potvrđuje valjanost korištenja potencijala dvostrukog bunara za opisivanje takvih neobičnih svojstava prehlađene vode.
Ponašanje prehlađene vode je od velikog interesa iz raznih razloga. Konkretno, određuje klimatske uvjete, mogućnost i način plovidbe u visokim geografskim širinama, što je relevantno za našu zemlju. Tijekom procesa dinamičke kristalizacije na granici se javljaju mnogi zanimljivi i još uvijek slabo shvaćeni fenomeni, na primjer, preraspodjela nečistoća, odvajanje i naknadno opuštanje električnih naboja, popraćeno elektromagnetskim zračenjem u širokom frekvencijskom pojasu, itd. Konačno, kristalizacija u visoko prehlađena tekućina izvrsna je, lako ponovljiva mnogo puta modelna situacija ponašanja sustava koji je daleko od termodinamičke ravnoteže i sposoban je, kao rezultat razvoja nestabilnosti, formirati dendrite različitih redova i dimenzija ( tipični predstavnici su snježne pahulje i ledeni uzorci na prozorima), pogodan za stvaranje i modeliranje ponašanja fraktala.
Na prvi pogled čini se da je procese topljenja leda lakše analizirati nego procese kristalizacije. Međutim, ostavljaju i mnoga pitanja. Na primjer, široko se vjeruje da otopljena voda neko vrijeme ima svojstva koja se razlikuju od svojstava obične vode, barem u odnosu na biološke objekte: biljke, životinje, ljude. Vjerojatno, te značajke mogu biti posljedica visoke kemijske čistoće (zbog zapaženog niskog koeficijenta hvatanja nečistoća tijekom kristalizacije leda), razlika u sadržaju otopljenih plinova i iona, kao i skladištenja strukture leda u multimolekularnim nakupinama tekućine. faza. Međutim, autor ne raspolaže pouzdanim podacima dobivenim suvremenim fizikalnim metodama o tome.
Ništa manje teško nije analizirati mehanizme utjecaja vanjskih fizikalnih polja, posebice magnetskih polja, na procese i svojstva vode, leda i faznih prijelaza. Cijeli naš život odvija se u uvjetima stalnog djelovanja Zemljinog magnetskog polja i njegovih slabih fluktuacija. Magnetobiologija i magnetske metode liječenja u medicini razvijale su se stoljećima. Konačno, jedinice se masovno proizvode i naširoko koriste za magnetiziranje vode koja se koristi za navodnjavanje u poljoprivredi (kako bi se povećala produktivnost), za napajanje parnih kotlova (kako bi se smanjila stopa stvaranja kamenca u njima), itd. Međutim, još uvijek nema zadovoljavajućeg fizikalnog opisa mehanizama djelovanja magnetskog polja u ovim i sličnim slučajevima.
Zaključak
Voda, led i njihove međusobne fazne transformacije još uvijek su prepune mnogih misterija. Njihovo rješavanje nije samo vrlo zanimljiv fizikalni problem, već je i iznimno važno za život na Zemlji, budući da je izravno povezano s ljudskim zdravljem i dobrobiti. Možda oni pružaju jedan od najupečatljivijih primjera uloge elektronske i molekularne strukture u formiranju fizikalnih svojstava najjednostavnijeg i dobro poznatog kemijskog sastava tvari.
Književnost:
1. Bogorodsky V.V., Gavrilo V.P. Led. L.: Gidrometeoizdat, 1980. 384 str.
2. Maeno N. Znanost o ledu. M.: Mir, 1988. 231 str.
3. Hobbs P.V. Fizika leda. Oxford: Univ. Press, 1974. 864 str.
4. Zatsepina G.N. Fizikalna svojstva i struktura vode. M.: Izdavačka kuća Moskovskog državnog sveučilišta, 1998. 184 str.
5. Mishima O., Stanley E. Odnos između tekuće, prehlađene i staklaste vode // Nature. 1998. Vol. 396. str. 329–335.
6. Zolotukhin I.V. Fraktali u fizici čvrstog stanja // Soros Educational Journal. 1998. broj 7. str. 108–113. Recenzent članka B.A. Strukov
Jurij Ivanovič Golovin, doktor fizičkih i matematičkih znanosti, profesor, voditelj. Odjel za teorijsku i eksperimentalnu fiziku Državnog sveučilišta Tambov. GR. Deržavin, počasni znanstvenik Ruske Federacije. Područje znanstvenog interesa je elektronska struktura defekata u čvrstim tijelima i njima uzrokovana makroskopska svojstva. Autor i koautor više od 200 znanstvenih radova, uključujući monografije i 40 izuma.
Led- mineral s kemijskim formula H 2 O, predstavlja vodu u kristalnom stanju.
Kemijski sastav leda: H - 11,2%, O - 88,8%. Ponekad sadrži plinovite i čvrste mehaničke nečistoće.
U prirodi je led predstavljen uglavnom jednom od nekoliko kristalnih modifikacija, stabilnih u temperaturnom rasponu od 0 do 80 °C, s talištem od 0 °C. Postoji 10 poznatih kristalnih modifikacija leda i amorfnog leda. Najviše je proučavan led 1. modifikacije - jedina modifikacija koja se nalazi u prirodi. Led se u prirodi nalazi u obliku samog leda (kontinentalni, plutajući, podzemni itd.), kao i u obliku snijega, inja itd.
Vidi također:
STRUKTURA
Kristalna struktura leda slična je strukturi: svaka molekula H 2 0 okružena je s četiri najbliže molekule koje se nalaze na jednakim udaljenostima od nje, jednake 2,76Α i nalaze se na vrhovima pravilnog tetraedra. Zbog niskog koordinacijskog broja, struktura leda je ažurna, što utječe na njegovu gustoću (0,917). Led ima heksagonalnu prostornu rešetku i nastaje smrzavanjem vode na 0°C i atmosferskom tlaku. Rešetka svih kristalnih modifikacija leda ima tetraedarsku strukturu. Parametri jedinične ćelije leda (pri t 0°C): a=0,45446 nm, c=0,73670 nm (c je dvostruka udaljenost između susjednih glavnih ravnina). Kad temperatura padne, vrlo se malo mijenjaju. Molekule H 2 0 u rešetki leda međusobno su povezane vodikovim vezama. Mobilnost atoma vodika u rešetki leda znatno je veća od pokretljivosti atoma kisika, zbog čega molekule mijenjaju svoje susjede. U prisutnosti značajnih vibracijskih i rotacijskih kretanja molekula u rešetki leda, dolazi do translatornih skokova molekula s mjesta njihove prostorne povezanosti, narušavajući daljnji red i stvarajući dislokacije. To objašnjava pojavu specifičnih reoloških svojstava u ledu, koja karakteriziraju odnos između ireverzibilnih deformacija (tečenja) leda i naprezanja koja su ih uzrokovala (plastičnost, viskoznost, granica tečenja, puzanje itd.). Zbog ovih okolnosti, ledenjaci teku slično visoko viskoznim tekućinama, pa prirodni led aktivno sudjeluje u vodenom ciklusu na Zemlji. Kristali leda relativno su veliki (poprečna veličina od djelića milimetra do nekoliko desetaka centimetara). Karakterizira ih anizotropija koeficijenta viskoznosti, čija vrijednost može varirati za nekoliko redova veličine. Kristali su sposobni preorijentirati se pod utjecajem opterećenja, što utječe na njihovu metamorfizaciju i protok ledenjaka.
SVOJSTVA

Led je bezbojan. U velikim grozdovima poprima plavkastu nijansu. Sjaj stakla. Transparentan. Nema dekoltea. Tvrdoća 1,5. Krhko. Optički pozitivan, indeks loma vrlo nizak (n = 1,310, nm = 1,309). U prirodi je poznato 14 modifikacija leda. Istina, sve osim poznatog leda, koji se kristalizira u heksagonalnom sustavu i označava se kao led I, nastaje u egzotičnim uvjetima - pri vrlo niskim temperaturama (oko -110150 0C) i visokim tlakovima, kada se kutevi vodikovih veza u vodi mijenjaju. mijenjaju se molekule i nastaju sustavi, različiti od heksagonalnih. Takvi uvjeti nalikuju onima u svemiru i ne događaju se na Zemlji. Na primjer, na temperaturama nižim od –110 °C vodena para se taloži na metalnu ploču u obliku oktaedra i kockica veličine nekoliko nanometara - to je takozvani kubični led. Ako je temperatura malo iznad –110 °C, a koncentracija pare vrlo niska, na ploči se stvara sloj iznimno gustog amorfnog leda.
MORFOLOGIJA

Led je vrlo čest mineral u prirodi. U zemljinoj kori postoji nekoliko vrsta leda: riječni, jezerski, morski, prizemni, firni i ledenjački. Češće tvori agregatne nakupine finih kristalnih zrnaca. Poznate su i kristalne ledene tvorevine koje nastaju sublimacijom, odnosno izravno iz parovitog stanja. U tim slučajevima led se pojavljuje kao skeletni kristali (pahulje) i nakupine skeletnog i dendritičkog rasta (špiljski led, inje, inje i šare na staklu). Veliki dobro brušeni kristali se nalaze, ali vrlo rijetko. N. N. Stulov opisao je kristale leda u sjeveroistočnom dijelu Rusije, pronađene na dubini od 55-60 m od površine, izometričnog i stupastog izgleda, a duljina najvećeg kristala bila je 60 cm, a promjer njegove baze bio je 15 cm Od jednostavnih oblika na kristalima leda identificirana su samo lica šesterokutne prizme (1120), šesterokutne bipiramide (1121) i pinakoida (0001).
Ledeni stalaktiti, kolokvijalno zvani ledenice, poznati su svima. Uz temperaturne razlike od oko 0° u jesensko-zimskom razdoblju, rastu posvuda po površini Zemlje uz polagano smrzavanje (kristalizaciju) tekuće i kapajuće vode. Također su česti u ledenim špiljama.
Ledeni sprudovi su trake ledenog pokrivača sastavljene od leda koji se kristalizira na granici voda-zrak uz rubove akumulacija i obrubljuje rubove lokvi, obale rijeka, jezera, ribnjaka, akumulacija itd. pri čemu se ostatak vodenog prostora ne smrzava. Kada se potpuno srastu, na površini rezervoara formira se kontinuirani ledeni pokrivač.
Led također stvara paralelne stupčaste agregate u obliku vlaknastih žila u poroznim tlima, a na njihovoj površini ledene antolite.
PODRIJETLO

Led se uglavnom stvara u vodenim bazenima kada temperatura zraka padne. Istodobno se na površini vode pojavljuje ledena kaša sastavljena od ledenih iglica. Odozdo na njemu rastu dugi kristali leda, čije su osi simetrije šestog reda okomite na površinu kore. Odnosi između kristala leda pod različitim uvjetima formiranja prikazani su na sl. Led je čest svugdje gdje ima vlage i gdje temperatura pada ispod 0° C. U nekim područjima led se otapa samo do male dubine, ispod koje počinje permafrost. To su takozvana permafrost područja; U područjima rasprostranjenosti permafrosta u gornjim slojevima zemljine kore nalazi se takozvani podzemni led, među kojima se razlikuju moderni i fosilni podzemni led. Najmanje 10% ukupne kopnene površine Zemlje prekriveno je ledenjacima; monolitna ledena stijena koja ih sačinjava naziva se ledenjački led. Ledenjački led nastaje prvenstveno nakupljanjem snijega kao rezultat njegovog zbijanja i transformacije. Ledeni pokrivač pokriva oko 75% Grenlanda i gotovo cijelu Antarktiku; najveća debljina ledenjaka (4330 m) nalazi se u blizini postaje Byrd (Antarktik). U središnjem Grenlandu debljina leda doseže 3200 m.
Naslage leda su dobro poznate. U područjima s hladnim, dugim zimama i kratkim ljetima, kao iu visokim planinskim predjelima, nastaju ledene špilje sa stalaktitima i stalagmitima, među kojima su najzanimljivije Kungurskaja u Permskoj oblasti na Uralu, kao i špilja Dobshine u Slovačka.
Kada se morska voda smrzne, nastaje morski led. Karakteristična svojstva morskog leda su salinitet i poroznost, koji određuju raspon njegove gustoće od 0,85 do 0,94 g/cm 3 . Zbog tako male gustoće, sante leda izdižu se iznad površine vode za 1/7-1/10 svoje debljine. Morski led počinje se topiti na temperaturama iznad -2,3°C; elastičniji je i teže ga je razbiti u komade od slatkovodnog leda.
PRIMJENA

U kasnim 1980-ima, laboratorij Argonne razvio je tehnologiju za izradu ledene kaše koja može slobodno teći kroz cijevi različitih promjera bez skupljanja u naslagama leda, lijepljenja ili začepljenja rashladnih sustava. Suspenzija slane vode sastojala se od mnogo vrlo malih ledenih kristala okruglog oblika. Zahvaljujući tome održava se pokretljivost vode, a istovremeno, sa stajališta toplinske tehnike, predstavlja led, koji je 5-7 puta učinkovitiji od obične hladne vode u sustavima hlađenja zgrada. Osim toga, takve smjese su obećavajuće za medicinu. Pokusi na životinjama pokazali su da mikrokristali ledene smjese savršeno prolaze u prilično male krvne žile i ne oštećuju stanice. “Ledena krv” produljuje vrijeme tijekom kojeg se žrtva može spasiti. Recimo, u slučaju srčanog zastoja to se vrijeme produljuje, prema konzervativnim procjenama, s 10-15 na 30-45 minuta.
Upotreba leda kao konstrukcijskog materijala raširena je u polarnim krajevima za gradnju nastambi – iglua. Led je dio Pikerit materijala koji je predložio D. Pike, od kojeg je predloženo da se napravi najveći svjetski nosač zrakoplova.
Led - H 2 O
KLASIFIKACIJA
| Strunz (8. izdanje) | 4/A.01-10 |
| Nickel-Strunz (10. izdanje) | 4.AA.05 |
| Dana (8. izdanje) | 4.1.2.1 |
| Hej, CIM Ref. | 7.1.1 |