Δομή του νερού. Ιδιότητες του νερού Οι κύριες διαφορές μεταξύ πάγου και νερού σε μοριακό επίπεδο
Από τις 14 προς το παρόν γνωστές μορφές στερεού νερού στη φύση, βρίσκουμε μόνο μία - τον πάγο. Τα υπόλοιπα σχηματίζονται κάτω από ακραίες συνθήκες και είναι απρόσιτα για παρατηρήσεις εκτός ειδικών εργαστηρίων. Η πιο ενδιαφέρουσα ιδιότητα του πάγου είναι η εκπληκτική ποικιλία των εξωτερικών εκδηλώσεών του. Με την ίδια κρυσταλλική δομή, μπορεί να φαίνεται εντελώς διαφορετικό, παίρνοντας τη μορφή διαφανών χαλαζόπετρων και παγετώνων, νιφάδων χνουδωτού χιονιού, πυκνής γυαλιστερής κρούστας ελάτης σε ένα πεδίο χιονιού ή γιγάντιες παγετώδεις μάζες.
Στη μικρή ιαπωνική πόλη Kaga, που βρίσκεται στη δυτική ακτή του νησιού Honshu, υπάρχει ένα ασυνήθιστο μουσείο. Χιόνι και πάγος. Ιδρύθηκε από τον Ukihiro Nakaya, τον πρώτο άνθρωπο που έμαθε να καλλιεργεί τεχνητές νιφάδες χιονιού στο εργαστήριο, τόσο όμορφες όσο αυτές που πέφτουν από τον ουρανό. Σε αυτό το μουσείο, οι επισκέπτες περιβάλλονται από όλες τις πλευρές από κανονικά εξάγωνα, γιατί ακριβώς αυτή η «εξαγωνική» συμμετρία είναι χαρακτηριστική των συνηθισμένων κρυστάλλων πάγου (παρεμπιπτόντως, η ελληνική λέξη kristallos σημαίνει στην πραγματικότητα «πάγος»). Καθορίζει πολλές από τις μοναδικές του ιδιότητες και κάνει τις νιφάδες χιονιού, με όλη την άπειρη ποικιλία τους, να μεγαλώνουν σε σχήμα αστεριών με έξι, λιγότερο συχνά τρεις ή δώδεκα ακτίνες, αλλά ποτέ με τέσσερις ή πέντε.
Μόρια σε διάτρητη εργασία
Το κλειδί για τη δομή του στερεού νερού βρίσκεται στη δομή του μορίου του. Το H2O μπορεί να αναπαρασταθεί απλοϊκά ως ένα τετράεδρο (μια πυραμίδα με τριγωνική βάση). Στο κέντρο υπάρχει οξυγόνο, σε δύο κορυφές υπάρχει ένα υδρογόνο, πιο συγκεκριμένα ένα πρωτόνιο, τα ηλεκτρόνια του οποίου συμμετέχουν στο σχηματισμό ενός ομοιοπολικού δεσμού με το οξυγόνο. Οι δύο εναπομείνασες κορυφές καταλαμβάνονται από ζεύγη ηλεκτρονίων σθένους οξυγόνου, τα οποία δεν συμμετέχουν στο σχηματισμό ενδομοριακών δεσμών, γι' αυτό και ονομάζονται μοναχικά.
Όταν ένα πρωτόνιο ενός μορίου αλληλεπιδρά με ένα ζεύγος μονά ηλεκτρονίων οξυγόνου ενός άλλου μορίου, σχηματίζεται ένας δεσμός υδρογόνου, λιγότερο ισχυρός από έναν ενδομοριακό δεσμό, αλλά αρκετά ισχυρός ώστε να συγκρατεί γειτονικά μόρια μαζί. Κάθε μόριο μπορεί ταυτόχρονα να σχηματίσει τέσσερις δεσμούς υδρογόνου με άλλα μόρια σε αυστηρά καθορισμένες γωνίες, που δεν επιτρέπουν τη δημιουργία μιας πυκνής δομής όταν παγώσει. Αυτό το αόρατο πλαίσιο δεσμών υδρογόνου τακτοποιεί τα μόρια σε ένα δαντελωτό δίκτυο με κοίλα κανάλια. Μόλις θερμανθεί ο πάγος, η δαντέλα καταρρέει: τα μόρια του νερού αρχίζουν να πέφτουν στα κενά του πλέγματος, οδηγώντας σε μια πιο πυκνή δομή του υγρού, γι' αυτό και το νερό είναι βαρύτερο από τον πάγο.Ο πάγος, ο οποίος σχηματίζεται σε ατμοσφαιρική πίεση και λιώνει στους 0°C, είναι η πιο κοινή, αλλά ακόμα όχι πλήρως κατανοητή, ουσία. Πολλά από τη δομή και τις ιδιότητές του φαίνονται ασυνήθιστα. Στις θέσεις του κρυσταλλικού πλέγματος του πάγου, τα άτομα οξυγόνου είναι διατεταγμένα με τάξη, σχηματίζοντας κανονικά εξάγωνα, αλλά τα άτομα υδρογόνου καταλαμβάνουν μια ποικιλία θέσεων κατά μήκος των δεσμών. Αυτή η συμπεριφορά των ατόμων είναι γενικά άτυπη - κατά κανόνα, σε μια στερεή ουσία όλοι υπακούουν στον ίδιο νόμο: είτε όλα τα άτομα είναι διατεταγμένα με τάξη, και μετά είναι κρύσταλλος, είτε τυχαία, και μετά είναι άμορφη ουσία.
Ο πάγος λιώνει δύσκολα, όσο περίεργο κι αν ακούγεται. Αν δεν υπήρχαν δεσμοί υδρογόνου που να συγκρατούν τα μόρια του νερού μαζί, θα έλιωνε στους 90°C. Ταυτόχρονα, όταν το νερό παγώνει, δεν μειώνεται σε όγκο, όπως συμβαίνει με τις περισσότερες γνωστές ουσίες, αλλά αυξάνεται λόγω του σχηματισμού μιας διάτρητης δομής πάγου.Οι «παραξενιές» του πάγου περιλαμβάνουν επίσης τη δημιουργία ηλεκτρομαγνητικής ακτινοβολίας από τους αναπτυσσόμενους κρυστάλλους του. Είναι γνωστό εδώ και καιρό ότι οι περισσότερες ακαθαρσίες που διαλύονται στο νερό δεν μεταφέρονται στον πάγο όταν αρχίζει να αναπτύσσεται· με άλλα λόγια, παγώνει. Επομένως, ακόμη και στην πιο βρώμικη λακκούβα, η μεμβράνη πάγου είναι καθαρή και διαφανής. Οι ακαθαρσίες συσσωρεύονται στη διεπιφάνεια μεταξύ στερεών και υγρών μέσων, με τη μορφή δύο στρωμάτων ηλεκτρικών φορτίων διαφορετικών σημάτων, τα οποία προκαλούν σημαντική διαφορά δυναμικού. Το φορτισμένο στρώμα ακαθαρσιών κινείται μαζί με το κάτω όριο του νεαρού πάγου και εκπέμπει ηλεκτρομαγνητικά κύματα. Χάρη σε αυτό, η διαδικασία κρυστάλλωσης μπορεί να παρατηρηθεί λεπτομερώς. Έτσι, ένας κρύσταλλος που αναπτύσσεται σε μήκος με τη μορφή βελόνας εκπέμπει διαφορετικά από εκείνον που καλύπτεται με πλευρικές διεργασίες και η ακτινοβολία των αναπτυσσόμενων κόκκων διαφέρει από αυτή που συμβαίνει όταν οι κρύσταλλοι σπάνε. Με το σχήμα, τη σειρά, τη συχνότητα και το πλάτος των παλμών ακτινοβολίας, μπορεί κανείς να προσδιορίσει με ποια ταχύτητα παγώνει ο πάγος και τι είδους δομή πάγου αποκτάται.
Λάθος πάγος
Σε στερεά κατάσταση, το νερό έχει, σύμφωνα με τα τελευταία δεδομένα, 14 δομικές τροποποιήσεις. Μερικά από αυτά είναι κρυσταλλικά (η πλειοψηφία τους), μερικά είναι άμορφα, αλλά όλα διαφέρουν μεταξύ τους ως προς τη σχετική διάταξη των μορίων του νερού και τις ιδιότητες. Είναι αλήθεια ότι όλα εκτός από τον πάγο που γνωρίζουμε σχηματίζονται κάτω από εξωτικές συνθήκες - σε πολύ χαμηλές θερμοκρασίες και υψηλές πιέσεις, όταν αλλάζουν οι γωνίες των δεσμών υδρογόνου στο μόριο του νερού και σχηματίζονται συστήματα διαφορετικά από τα εξαγωνικά. Για παράδειγμα, σε θερμοκρασίες κάτω των 110°C, οι υδρατμοί κατακρημνίζονται σε μια μεταλλική πλάκα με τη μορφή οκτάεδρων και σχηματίζουν κύβους σε μέγεθος αρκετών νανόμετρων - αυτός είναι ο λεγόμενος κυβικός πάγος. Εάν η θερμοκρασία είναι ελαφρώς πάνω από 110° και η συγκέντρωση ατμών είναι πολύ χαμηλή, σχηματίζεται ένα στρώμα εξαιρετικά πυκνού άμορφου πάγου στην πλάκα.
Οι δύο τελευταίες τροποποιήσεις του πάγου XIII και XIV ανακαλύφθηκαν από επιστήμονες από την Οξφόρδη πολύ πρόσφατα, το 2006. Η 40χρονη πρόβλεψη ότι θα έπρεπε να υπάρχουν κρύσταλλοι πάγου με μονοκλινικά και ρομβικά πλέγματα ήταν δύσκολο να επιβεβαιωθεί: το ιξώδες του νερού σε θερμοκρασία 160 ° C είναι πολύ υψηλό και τα μόρια του εξαιρετικά καθαρού υπερψυκτικού νερού ενώνονται σε τέτοιες ποσότητες να σχηματίσει έναν κρυστάλλινο πυρήνα, δύσκολο. Ο καταλύτης βοήθησε: το υδροχλωρικό οξύ, το οποίο αύξησε την κινητικότητα των μορίων του νερού σε χαμηλές θερμοκρασίες. Τέτοιες τροποποιήσεις του πάγου δεν μπορούν να σχηματιστούν στην επίγεια φύση, αλλά μπορούν να αναζητηθούν στους παγωμένους δορυφόρους άλλων πλανητών.
Έτσι αποφάσισε η επιτροπήΗ νιφάδα χιονιού είναι ένας ενιαίος κρύσταλλος πάγου, μια παραλλαγή του θέματος ενός εξαγωνικού κρυστάλλου, που όμως αναπτύχθηκε γρήγορα υπό συνθήκες μη ισορροπίας. Τα πιο περίεργα μυαλά παλεύουν με το μυστικό της ομορφιάς και της ατελείωτης διαφορετικότητάς τους εδώ και αιώνες. Ο αστρονόμος Johannes Kepler έγραψε μια ολόκληρη πραγματεία «On Hexagonal Snowflakes» το 1611. Το 1665, ο Ρόμπερτ Χουκ, σε έναν τεράστιο όγκο σκίτσων από όλα όσα είδε με μικροσκόπιο, δημοσίευσε πολλά σχέδια από νιφάδες χιονιού διαφόρων σχημάτων. Η πρώτη επιτυχημένη φωτογραφία μιας νιφάδας χιονιού κάτω από μικροσκόπιο τραβήχτηκε το 1885 από τον Αμερικανό αγρότη Wilson Bentley. Από τότε δεν μπορούσε να σταματήσει. Μέχρι το τέλος της ζωής του, για περισσότερα από σαράντα χρόνια, η Bentley τους φωτογράφιζε. Περισσότεροι από πέντε χιλιάδες κρύσταλλοι, και κανένας δεν είναι ίδιος.
Οι πιο διάσημοι οπαδοί της υπόθεσης του Bentley είναι ο ήδη αναφερόμενος Ukihiro Nakaya και ο Αμερικανός φυσικός Kenneth Libbrecht. Ο Nakaya ήταν ο πρώτος που πρότεινε ότι το μέγεθος και το σχήμα των νιφάδων χιονιού εξαρτώνται από τη θερμοκρασία του αέρα και την περιεκτικότητα σε υγρασία, και επιβεβαίωσε έξοχα αυτή την υπόθεση πειραματικά αναπτύσσοντας κρυστάλλους πάγου διαφορετικών σχημάτων στο εργαστήριο. Και ο Libbrecht άρχισε να καλλιεργεί νιφάδες χιονιού κατά παραγγελία με προκαθορισμένο σχήμα.
Η ζωή μιας νιφάδας χιονιού ξεκινά με το σχηματισμό κρυσταλλικών πυρήνων πάγου σε ένα σύννεφο υδρατμών καθώς η θερμοκρασία πέφτει. Το κέντρο της κρυστάλλωσης μπορεί να είναι σωματίδια σκόνης, οποιαδήποτε στερεά σωματίδια ή ακόμα και ιόντα, αλλά σε κάθε περίπτωση, αυτά τα κομμάτια πάγου μεγέθους μικρότερου από το ένα δέκατο του χιλιοστού έχουν ήδη ένα εξαγωνικό κρυσταλλικό πλέγμα.
Οι υδρατμοί, που συμπυκνώνονται στην επιφάνεια αυτών των πυρήνων, σχηματίζουν πρώτα ένα μικροσκοπικό εξαγωνικό πρίσμα, από τις έξι γωνίες του οποίου αρχίζουν να αναπτύσσονται εντελώς πανομοιότυπες βελόνες πάγου και πλευρικές διεργασίες. Είναι τα ίδια απλά επειδή η θερμοκρασία και η υγρασία γύρω από το έμβρυο είναι επίσης ίδιες. Πάνω τους, με τη σειρά τους, αναπτύσσονται πλευρικοί βλαστοί και κλαδιά, όπως σε ένα δέντρο. Τέτοιοι κρύσταλλοι ονομάζονται δενδρίτες, δηλαδή παρόμοιοι με το ξύλο.
Κινούμενη πάνω-κάτω σε ένα σύννεφο, μια νιφάδα χιονιού συναντά συνθήκες με διαφορετικές θερμοκρασίες και συγκεντρώσεις υδρατμών. Το σχήμα του αλλάζει, υπακούοντας μέχρι το τέλος στους νόμους της εξαγωνικής συμμετρίας. Έτσι διαφέρουν οι νιφάδες χιονιού. Αν και θεωρητικά, στο ίδιο σύννεφο στο ίδιο υψόμετρο, μπορούν να «αναδυθούν» πανομοιότυπα. Αλλά το καθένα έχει τη δική του διαδρομή προς το έδαφος, η οποία είναι αρκετά μεγάλη· κατά μέσο όρο, μια νιφάδα χιονιού πέφτει με ταχύτητα 0,9 χλμ. την ώρα. Αυτό σημαίνει ότι το καθένα έχει τη δική του ιστορία και τη δική του τελική μορφή. Ο πάγος που σχηματίζει μια νιφάδα χιονιού είναι διαφανής, αλλά όταν υπάρχουν πολλά από αυτά, το φως του ήλιου, που αντανακλάται και διασκορπίζεται σε πολλά πρόσωπα, μας δίνει την εντύπωση μιας λευκής αδιαφανούς μάζας - το λέμε χιόνι.
Για να αποφευχθεί η σύγχυση με την ποικιλία των νιφάδων χιονιού, η Διεθνής Επιτροπή για το Χιόνι και τον Πάγο υιοθέτησε το 1951 μια αρκετά απλή ταξινόμηση των κρυστάλλων πάγου: πλάκες, κρύσταλλοι αστεριών, στήλες ή στήλες, βελόνες, χωρικοί δενδρίτες, κολώνες με άκρες και ακανόνιστα σχήματα. Και τρεις ακόμη τύποι παγωμένης βροχόπτωσης: ψιλά σφαιρίδια χιονιού, σφαιρίδια πάγου και χαλάζι.Η ανάπτυξη του παγετού, του παγετού και των μοτίβων στο γυαλί υπόκειται στους ίδιους νόμους. Αυτά τα φαινόμενα, όπως οι νιφάδες χιονιού, σχηματίζονται από τη συμπύκνωση, μόριο με μόριο, στο έδαφος, γρασίδι, δέντρα. Τα σχέδια στο παράθυρο εμφανίζονται σε παγωμένο καιρό, όταν η υγρασία από τον ζεστό αέρα του δωματίου συμπυκνώνεται στην επιφάνεια του γυαλιού. Αλλά το χαλάζι σχηματίζεται όταν παγώνουν σταγόνες νερού ή όταν ο πάγος σε σύννεφα κορεσμένα με υδρατμούς παγώνει σε πυκνά στρώματα πάνω στα έμβρυα των νιφάδων χιονιού. Άλλες, ήδη σχηματισμένες νιφάδες χιονιού μπορούν να παγώσουν πάνω σε χαλάζι, συντηγόμενες μαζί τους, εξαιτίας των οποίων οι πέτρες του χαλαζιού παίρνουν τα πιο παράξενα σχήματα.
Για εμάς στη Γη, αρκεί μια στερεή τροποποίηση του νερού - ο συνηθισμένος πάγος. Κυριολεκτικά διαποτίζει όλους τους τομείς της ανθρώπινης κατοίκησης ή διαμονής. Συλλέγοντας σε τεράστιες ποσότητες, το χιόνι και ο πάγος σχηματίζουν ειδικές δομές με ιδιότητες που είναι θεμελιωδώς διαφορετικές από αυτές των μεμονωμένων κρυστάλλων ή των νιφάδων χιονιού. Οι παγετώνες βουνών, τα καλύμματα πάγου των υδάτινων περιοχών, ο μόνιμος παγετός και απλώς η εποχική χιονοκάλυψη επηρεάζουν σημαντικά το κλίμα των μεγάλων περιοχών και του πλανήτη συνολικά: ακόμη και εκείνοι που δεν έχουν δει ποτέ χιόνι αισθάνονται την ανάσα των μαζών του που συσσωρεύονται στους πόλους της Γης, για παράδειγμα, με τη μορφή μακροπρόθεσμων διακυμάνσεων στη στάθμη του Παγκόσμιου Ωκεανού. Και ο πάγος είναι τόσο σημαντικός για την εμφάνιση του πλανήτη μας και τον άνετο βιότοπο των ζωντανών πλασμάτων σε αυτόν που οι επιστήμονες έχουν διαθέσει ένα ειδικό περιβάλλον για αυτόν - την κρυόσφαιρα, η οποία επεκτείνει την επικράτειά του ψηλά στην ατμόσφαιρα και βαθιά στον φλοιό της γης.
Όλγα Μαξιμένκο, Υποψήφια Χημικών Επιστημών
Προσαρμοσμένη αναζήτηση
Δομή νερού
Ph.D. O.V. Mosin
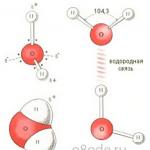
Ένα μόριο νερού είναι ένα μικρό δίπολο που περιέχει θετικά και αρνητικά φορτία στους πόλους του. Δεδομένου ότι η μάζα και το φορτίο του πυρήνα του οξυγόνου είναι μεγαλύτερο από αυτό των πυρήνων του υδρογόνου, το νέφος ηλεκτρονίων έλκεται προς τον πυρήνα του οξυγόνου. Σε αυτή την περίπτωση, οι πυρήνες του υδρογόνου εκτίθενται. Έτσι, το νέφος ηλεκτρονίων έχει ανομοιόμορφη πυκνότητα. Υπάρχει έλλειψη πυκνότητας ηλεκτρονίων κοντά στους πυρήνες του υδρογόνου και στην αντίθετη πλευρά του μορίου, κοντά στον πυρήνα του οξυγόνου, υπάρχει περίσσεια ηλεκτρονιακής πυκνότητας. Αυτή η δομή είναι που καθορίζει την πολικότητα του μορίου του νερού. Εάν συνδέσετε τα επίκεντρα θετικών και αρνητικών φορτίων με ευθείες γραμμές, λαμβάνετε ένα τρισδιάστατο γεωμετρικό σχήμα - ένα κανονικό τετράεδρο.
 Η δομή ενός μορίου νερού (εικόνα στα δεξιά)
Η δομή ενός μορίου νερού (εικόνα στα δεξιά)
Λόγω της παρουσίας δεσμών υδρογόνου, κάθε μόριο νερού σχηματίζει έναν δεσμό υδρογόνου με 4 γειτονικά μόρια, σχηματίζοντας ένα διάτρητο δικτυωτό πλαίσιο στο μόριο του πάγου. Ωστόσο, στην υγρή κατάσταση, το νερό είναι ένα διαταραγμένο υγρό. Αυτοί οι δεσμοί υδρογόνου είναι αυθόρμητοι, βραχύβιοι, σπάνε γρήγορα και σχηματίζονται ξανά. Όλα αυτά οδηγούν σε ετερογένεια στη δομή του νερού.
 Δεσμοί υδρογόνου μεταξύ μορίων νερού (εικόνα κάτω αριστερά)
Δεσμοί υδρογόνου μεταξύ μορίων νερού (εικόνα κάτω αριστερά)
Το γεγονός ότι το νερό είναι ετερογενές στη σύστασή του έχει διαπιστωθεί εδώ και πολύ καιρό. Είναι από καιρό γνωστό ότι ο πάγος επιπλέει στην επιφάνεια του νερού, δηλαδή η πυκνότητα του κρυσταλλικού πάγου είναι μικρότερη από την πυκνότητα του υγρού.
Για όλες σχεδόν τις άλλες ουσίες, ο κρύσταλλος είναι πιο πυκνός από την υγρή φάση. Επιπλέον, ακόμη και μετά την τήξη, με την αύξηση της θερμοκρασίας, η πυκνότητα του νερού συνεχίζει να αυξάνεται και φτάνει στο μέγιστο στους 4 C. Λιγότερο γνωστή είναι η ανωμαλία της συμπιεστότητας του νερού: όταν θερμαίνεται από το σημείο τήξης στους 40 C, μειώνεται και στη συνέχεια αυξάνεται. Η θερμοχωρητικότητα του νερού εξαρτάται επίσης μη μονοτονικά από τη θερμοκρασία.
Επιπλέον, σε θερμοκρασίες κάτω των 30 C, με αύξηση της πίεσης από την ατμοσφαιρική σε 0,2 GPa, το ιξώδες του νερού μειώνεται και ο συντελεστής αυτοδιάχυσης, μια παράμετρος που καθορίζει την ταχύτητα κίνησης των μορίων του νερού μεταξύ τους, αυξάνεται.
Για άλλα υγρά η σχέση είναι αντίθετη και σχεδόν πουθενά δεν συμβαίνει κάποια σημαντική παράμετρος να συμπεριφέρεται μη μονοτονικά, δηλ. αρχικά αυξήθηκε, και αφού περάσει μια κρίσιμη τιμή θερμοκρασίας ή πίεσης μειώθηκε. Προέκυψε μια υπόθεση ότι στην πραγματικότητα το νερό δεν είναι ένα ενιαίο υγρό, αλλά ένα μείγμα δύο συστατικών που διαφέρουν ως προς τις ιδιότητες, για παράδειγμα, την πυκνότητα και το ιξώδες, και επομένως τη δομή. Τέτοιες ιδέες άρχισαν να προκύπτουν στα τέλη του 19ου αιώνα, όταν συσσωρεύτηκαν πολλά δεδομένα για τις ανωμαλίες του νερού.
Ο Γουάιτινγκ ήταν ο πρώτος που πρότεινε την ιδέα ότι το νερό αποτελείται από δύο συστατικά το 1884. Η συγγραφή του αναφέρεται από τον E.F. Fritsman στη μονογραφία «The Nature of Water. Heavy Water», που δημοσιεύτηκε το 1935. Το 1891, ο V. Rengten εισήγαγε την έννοια των δύο καταστάσεων του νερού, οι οποίες διαφέρουν ως προς την πυκνότητα. Μετά από αυτό, εμφανίστηκαν πολλά έργα στα οποία το νερό θεωρήθηκε ως μείγμα συνεργατών διαφορετικών συνθέσεων (υδρόλες).
Όταν προσδιορίστηκε η δομή του πάγου στη δεκαετία του 1920, αποδείχθηκε ότι τα μόρια του νερού σε κρυσταλλική κατάσταση σχηματίζουν ένα τρισδιάστατο συνεχές δίκτυο στο οποίο κάθε μόριο έχει τέσσερις πλησιέστερους γείτονες που βρίσκονται στις κορυφές ενός κανονικού τετραέδρου. Το 1933, οι J. Bernal και P. Fowler πρότειναν ότι ένα παρόμοιο δίκτυο υπάρχει σε υγρό νερό. Δεδομένου ότι το νερό είναι πιο πυκνό από τον πάγο, πίστευαν ότι τα μόρια σε αυτό δεν είναι διατεταγμένα όπως στον πάγο, δηλαδή, όπως τα άτομα πυριτίου στον ορυκτό τριδυμίτη, αλλά όπως τα άτομα πυριτίου σε μια πιο πυκνή τροποποίηση του πυριτίου, τον χαλαζία. Η αύξηση της πυκνότητας του νερού όταν θερμαίνεται από 0 στους 4 C εξηγείται από την παρουσία του συστατικού του τριδυμίτη σε χαμηλές θερμοκρασίες. Έτσι, το μοντέλο του Bernal Fowler διατήρησε το στοιχείο των δύο δομών, αλλά το κύριο επίτευγμά τους ήταν η ιδέα ενός συνεχούς τετραεδρικού δικτύου. Τότε εμφανίστηκε ο περίφημος αφορισμός του I. Langmuir: «Ο ωκεανός είναι ένα μεγάλο μόριο». Οι υπερβολικές προδιαγραφές του μοντέλου δεν αύξησαν τον αριθμό των υποστηρικτών της θεωρίας του ενιαίου πλέγματος.
Μόλις το 1951 ο J. Pople δημιούργησε ένα μοντέλο συνεχούς πλέγματος, το οποίο δεν ήταν τόσο συγκεκριμένο όσο το μοντέλο του Bernal Fowler. Ο Pople φαντάστηκε το νερό ως ένα τυχαίο τετραεδρικό δίκτυο, οι δεσμοί μεταξύ των μορίων στα οποία είναι καμπυλωτά και έχουν διαφορετικά μήκη. Το μοντέλο του Pople εξηγεί τη συμπίεση του νερού κατά την τήξη με την κάμψη των δεσμών. Όταν εμφανίστηκαν οι πρώτοι ορισμοί της δομής των πάγων II και IX στη δεκαετία του 60-70, έγινε σαφές πώς η κάμψη των δεσμών μπορεί να οδηγήσει σε συμπύκνωση της δομής. Το μοντέλο του Pople δεν μπορούσε να εξηγήσει τη μη μονοτονική εξάρτηση των ιδιοτήτων του νερού από τη θερμοκρασία και την πίεση καθώς και από μοντέλα δύο καταστάσεων. Ως εκ τούτου, η ιδέα των δύο κρατών ήταν κοινή από πολλούς επιστήμονες για μεγάλο χρονικό διάστημα.
Αλλά στο δεύτερο μισό του 20ου αιώνα ήταν αδύνατο να φανταστούμε τη σύνθεση και τη δομή των υδρολών όπως έκαναν στις αρχές του αιώνα. Ήταν ήδη γνωστό πώς λειτουργούν ο πάγος και οι κρυσταλλικοί υδρίτες και γνώριζαν πολλά για τους δεσμούς υδρογόνου. Εκτός από τα μοντέλα συνεχούς (μοντέλο του Pople), έχουν προκύψει δύο ομάδες μικτών μοντέλων: το cluster και το clathrate. Στην πρώτη ομάδα, το νερό εμφανίστηκε με τη μορφή συστάδων μορίων συνδεδεμένων με δεσμούς υδρογόνου, τα οποία επέπλεαν σε μια θάλασσα μορίων που δεν εμπλέκονται σε τέτοιους δεσμούς. Η δεύτερη ομάδα μοντέλων αντιμετώπισε το νερό ως ένα συνεχές δίκτυο (που συνήθως ονομάζεται πλαίσιο σε αυτό το πλαίσιο) δεσμών υδρογόνου που περιείχε κενά. περιέχουν μόρια που δεν σχηματίζουν δεσμούς με τα μόρια του πλαισίου. Δεν ήταν δύσκολο να επιλεγούν οι ιδιότητες και οι συγκεντρώσεις δύο μικροφάσεων μοντέλων συστάδων ή οι ιδιότητες του πλαισίου και ο βαθμός πλήρωσης των κενών του μοντέλων clathrate προκειμένου να εξηγηθούν όλες οι ιδιότητες του νερού, συμπεριλαμβανομένων των περίφημων ανωμαλιών.
Από τα μοντέλα της ομάδας, το πιο εντυπωσιακό ήταν το μοντέλο των Γ. Νεμέτη και Χ. Σεράγη: Οι εικόνες που πρότειναν, που απεικονίζουν συστάδες δεσμευμένων μορίων να επιπλέουν σε μια θάλασσα από αδέσμευτα μόρια, συμπεριλήφθηκαν σε πολλές μονογραφίες.
Το πρώτο μοντέλο του τύπου clathrate προτάθηκε το 1946 από τον O.Ya. Samoilov: στο νερό διατηρείται ένα δίκτυο δεσμών υδρογόνου παρόμοιο με τον εξαγωνικό πάγο, οι κοιλότητες του οποίου είναι μερικώς γεμάτες με μόρια μονομερούς. Ο L. Pauling το 1959 δημιούργησε μια άλλη επιλογή, προτείνοντας ότι η βάση της δομής θα μπορούσε να είναι ένα δίκτυο δεσμών εγγενών σε ορισμένους κρυσταλλικούς υδρίτες.
Κατά το δεύτερο μισό της δεκαετίας του '60 και τις αρχές της δεκαετίας του '70, παρατηρήθηκε σύγκλιση όλων αυτών των απόψεων. Εμφανίστηκαν παραλλαγές μοντέλων συστάδων στις οποίες τα μόρια και στις δύο μικροφάσεις συνδέονται με δεσμούς υδρογόνου. Οι υποστηρικτές των μοντέλων clathrate άρχισαν να παραδέχονται το σχηματισμό δεσμών υδρογόνου μεταξύ μορίων κενού και πλαισίου. Δηλαδή, στην πραγματικότητα, οι συγγραφείς αυτών των μοντέλων θεωρούν το νερό ως ένα συνεχές δίκτυο δεσμών υδρογόνου. Και μιλάμε για το πόσο ετερογενές είναι αυτό το πλέγμα (για παράδειγμα, σε πυκνότητα). Η ιδέα του νερού ως συστάδων με δεσμούς υδρογόνου που επιπλέουν σε μια θάλασσα αδέσμευτων μορίων νερού τερματίστηκε στις αρχές της δεκαετίας του ογδόντα, όταν ο G. Stanley εφάρμοσε τη θεωρία της διήθησης, η οποία περιγράφει τις μεταβάσεις φάσης του νερού, στο μοντέλο νερού.
Το 1999, ο διάσημος Ρώσος ερευνητής νερού S.V. Ο Ζενίν υπερασπίστηκε τη διδακτορική του διατριβή στο Ινστιτούτο Ιατρικών και Βιολογικών Προβλημάτων της Ρωσικής Ακαδημίας Επιστημών σχετικά με τη θεωρία των συστάδων, η οποία ήταν ένα σημαντικό βήμα στην πρόοδο αυτού του τομέα έρευνας, η πολυπλοκότητα του οποίου ενισχύεται από το γεγονός ότι βρίσκονται στη διασταύρωση τριών επιστημών: της φυσικής, της χημείας και της βιολογίας. Με βάση δεδομένα που ελήφθησαν με τρεις φυσικοχημικές μεθόδους: διαθλασιμετρία (S.V. Zenin, B.V. Tyaglov, 1994), υγρή χρωματογραφία υψηλής απόδοσης (S.V. Zenin et al., 1998) και μαγνητικός συντονισμός πρωτονίων (C S.V. Zenin, 1993 και αποδεδειγμένη κατασκευή) μοντέλο του κύριου σταθερού δομικού σχηματισμού μορίων νερού (δομημένο νερό) και στη συνέχεια (S.V. Zenin, 2004) ελήφθη μια εικόνα αυτών των δομών χρησιμοποιώντας ένα μικροσκόπιο φάσης αντίθεσης.
 Η επιστήμη έχει πλέον αποδείξει ότι οι ιδιαιτερότητες των φυσικών ιδιοτήτων του νερού και οι πολυάριθμοι βραχύβιοι δεσμοί υδρογόνου μεταξύ γειτονικών ατόμων υδρογόνου και οξυγόνου σε ένα μόριο νερού δημιουργούν ευνοϊκές ευκαιρίες για το σχηματισμό ειδικών σχετικών δομών (συστάδων) που αντιλαμβάνονται, αποθηκεύουν και μεταδίδουν μεγάλη ποικιλία πληροφοριών.
Η επιστήμη έχει πλέον αποδείξει ότι οι ιδιαιτερότητες των φυσικών ιδιοτήτων του νερού και οι πολυάριθμοι βραχύβιοι δεσμοί υδρογόνου μεταξύ γειτονικών ατόμων υδρογόνου και οξυγόνου σε ένα μόριο νερού δημιουργούν ευνοϊκές ευκαιρίες για το σχηματισμό ειδικών σχετικών δομών (συστάδων) που αντιλαμβάνονται, αποθηκεύουν και μεταδίδουν μεγάλη ποικιλία πληροφοριών.
Η δομική μονάδα αυτού του νερού είναι ένα σύμπλεγμα που αποτελείται από clathrates, η φύση του οποίου καθορίζεται από δυνάμεις Coulomb μεγάλης εμβέλειας. Η δομή των συστάδων κωδικοποιεί πληροφορίες σχετικά με τις αλληλεπιδράσεις που έλαβαν χώρα με αυτά τα μόρια του νερού. Σε συστάδες νερού, λόγω της αλληλεπίδρασης μεταξύ ομοιοπολικών δεσμών και δεσμών υδρογόνου μεταξύ ατόμων οξυγόνου και ατόμων υδρογόνου, η μετανάστευση ενός πρωτονίου (Η+) μπορεί να συμβεί μέσω ενός μηχανισμού αναμετάδοσης, οδηγώντας σε μετεγκατάσταση του πρωτονίου μέσα στο σύμπλεγμα.
Το νερό, που αποτελείται από πολλές συστάδες διαφόρων τύπων, σχηματίζει μια ιεραρχική χωρική δομή υγρών κρυστάλλων που μπορεί να αντιληφθεί και να αποθηκεύσει τεράστιες ποσότητες πληροφοριών.
Το σχήμα (V.L. Voeikov) δείχνει διαγράμματα πολλών απλών δομών συστάδων ως παράδειγμα.
Μερικές πιθανές δομές συστάδων νερού

Φυσικά πεδία πολύ διαφορετικής φύσης μπορούν να είναι φορείς πληροφοριών. Έτσι, έχει καθιερωθεί η δυνατότητα απομακρυσμένης αλληλεπίδρασης πληροφοριών της υγρής κρυσταλλικής δομής του νερού με αντικείμενα διαφόρων φύσεων χρησιμοποιώντας ηλεκτρομαγνητικά, ακουστικά και άλλα πεδία. Το αντικείμενο που επηρεάζει μπορεί επίσης να είναι ένα άτομο.
Το νερό είναι πηγή εξαιρετικά αδύναμης και ασθενούς εναλλασσόμενης ηλεκτρομαγνητικής ακτινοβολίας. Η λιγότερο χαοτική ηλεκτρομαγνητική ακτινοβολία δημιουργείται από δομημένο νερό. Σε αυτή την περίπτωση, μπορεί να συμβεί η επαγωγή ενός αντίστοιχου ηλεκτρομαγνητικού πεδίου, αλλάζοντας τα δομικά και πληροφοριακά χαρακτηριστικά των βιολογικών αντικειμένων.
Τα τελευταία χρόνια έχουν ληφθεί σημαντικά δεδομένα για τις ιδιότητες του υπερψυκτικού νερού. Η μελέτη του νερού σε χαμηλές θερμοκρασίες είναι πολύ ενδιαφέρουσα, καθώς μπορεί να υπερψυχθεί περισσότερο από άλλα υγρά. Η κρυστάλλωση του νερού, κατά κανόνα, ξεκινάει σε ορισμένες ανομοιογένειες είτε στα τοιχώματα του δοχείου είτε σε αιωρούμενα σωματίδια στερεών ακαθαρσιών. Ως εκ τούτου, δεν είναι εύκολο να βρεθεί η θερμοκρασία στην οποία υπερψυγμένο νερό θα κρυσταλλωθεί αυθόρμητα. Αλλά οι επιστήμονες το κατάφεραν και τώρα η θερμοκρασία της λεγόμενης ομοιογενούς πυρήνωσης, όταν ο σχηματισμός κρυστάλλων πάγου συμβαίνει ταυτόχρονα σε ολόκληρο τον όγκο, είναι γνωστή για πιέσεις έως και 0,3 GPa, δηλαδή, που καλύπτει τις περιοχές ύπαρξης πάγος II.
Από την ατμοσφαιρική πίεση μέχρι τα όρια που χωρίζουν τους πάγους I και II, αυτή η θερμοκρασία πέφτει από 231 σε 180 Κ και στη συνέχεια αυξάνεται ελαφρά στους 190 Κ. Κάτω από αυτή την κρίσιμη θερμοκρασία, το νερό σε υγρή μορφή είναι κατ' αρχήν αδύνατο.
Δομή πάγου (εικόνα στα δεξιά)
 Ωστόσο, υπάρχει ένα μυστήριο που σχετίζεται με αυτή τη θερμοκρασία. Στα μέσα της δεκαετίας του ογδόντα, ανακαλύφθηκε μια νέα τροποποίηση του άμορφου πάγου - πάγος υψηλής πυκνότητας, και αυτό βοήθησε να αναβιώσει η ιδέα του νερού ως μείγματος δύο καταστάσεων. Ως πρωτότυπα θεωρήθηκαν όχι κρυσταλλικές δομές, αλλά δομές άμορφου πάγου διαφορετικών πυκνοτήτων. Αυτή η ιδέα διατυπώθηκε με την πιο ξεκάθαρη μορφή από τους E.G. Ponyatovsky και V.V. Sinitsin, οι οποίοι έγραψαν το 1999: «Το νερό θεωρείται ως μια κανονική λύση δύο συστατικών, οι τοπικές διαμορφώσεις στις οποίες αντιστοιχούν στη μικρής εμβέλειας σειρά τροποποιήσεων του άμορφου πάγου. .» Επιπλέον, μελετώντας τη σειρά μικρής εμβέλειας σε υπερψυγμένο νερό σε υψηλή πίεση χρησιμοποιώντας μεθόδους περίθλασης νετρονίων, οι επιστήμονες μπόρεσαν να βρουν συστατικά που αντιστοιχούν σε αυτές τις δομές.
Ωστόσο, υπάρχει ένα μυστήριο που σχετίζεται με αυτή τη θερμοκρασία. Στα μέσα της δεκαετίας του ογδόντα, ανακαλύφθηκε μια νέα τροποποίηση του άμορφου πάγου - πάγος υψηλής πυκνότητας, και αυτό βοήθησε να αναβιώσει η ιδέα του νερού ως μείγματος δύο καταστάσεων. Ως πρωτότυπα θεωρήθηκαν όχι κρυσταλλικές δομές, αλλά δομές άμορφου πάγου διαφορετικών πυκνοτήτων. Αυτή η ιδέα διατυπώθηκε με την πιο ξεκάθαρη μορφή από τους E.G. Ponyatovsky και V.V. Sinitsin, οι οποίοι έγραψαν το 1999: «Το νερό θεωρείται ως μια κανονική λύση δύο συστατικών, οι τοπικές διαμορφώσεις στις οποίες αντιστοιχούν στη μικρής εμβέλειας σειρά τροποποιήσεων του άμορφου πάγου. .» Επιπλέον, μελετώντας τη σειρά μικρής εμβέλειας σε υπερψυγμένο νερό σε υψηλή πίεση χρησιμοποιώντας μεθόδους περίθλασης νετρονίων, οι επιστήμονες μπόρεσαν να βρουν συστατικά που αντιστοιχούν σε αυτές τις δομές.
Μια συνέπεια του πολυμορφισμού του άμορφου πάγου οδήγησε επίσης σε υποθέσεις σχετικά με το διαχωρισμό του νερού σε δύο μη αναμίξιμα συστατικά σε θερμοκρασίες κάτω από το υποθετικό κρίσιμο σημείο χαμηλής θερμοκρασίας. Δυστυχώς, σύμφωνα με τους ερευνητές, αυτή η θερμοκρασία σε πίεση 0,017 GPa είναι 230 K κάτω από τη θερμοκρασία πυρήνωσης, επομένως κανείς δεν έχει καταφέρει ακόμη να παρατηρήσει τη στρωματοποίηση του υγρού νερού. Έτσι, η αναβίωση του μοντέλου των δύο καταστάσεων έθεσε το ερώτημα της ετερογένειας του δικτύου δεσμών υδρογόνου σε υγρό νερό. Αυτή η ετερογένεια μπορεί να γίνει κατανοητή μόνο χρησιμοποιώντας μοντελοποίηση υπολογιστή.
Μιλώντας για την κρυσταλλική δομή του νερού, πρέπει να σημειωθεί ότι είναι γνωστές 14 τροποποιήσεις του πάγου,τα περισσότερα από τα οποία δεν βρίσκονται στη φύση, στην οποία τα μόρια του νερού διατηρούν τόσο την ατομικότητά τους όσο και συνδέονται με δεσμούς υδρογόνου. Από την άλλη πλευρά, υπάρχουν πολλές παραλλαγές του δικτύου δεσμών υδρογόνου σε ένυδρες ενώσεις εγκλωβισμού. Οι ενέργειες αυτών των δικτύων (πάγοι υψηλής πίεσης και ένυδρες ενώσεις) δεν είναι πολύ υψηλότερες από τις ενέργειες των κυβικών και εξαγωνικών πάγων. Επομένως, θραύσματα τέτοιων δομών μπορούν επίσης να εμφανιστούν σε υγρό νερό. Είναι δυνατό να κατασκευαστούν αμέτρητα διαφορετικά μη περιοδικά θραύσματα, τα μόρια των οποίων έχουν τέσσερις πλησιέστερους γείτονες που βρίσκονται περίπου στις κορυφές του τετραέδρου, αλλά η δομή τους δεν αντιστοιχεί στις δομές των γνωστών τροποποιήσεων του πάγου. Όπως έχουν δείξει πολυάριθμοι υπολογισμοί, οι ενέργειες αλληλεπίδρασης των μορίων σε τέτοια θραύσματα θα είναι κοντά η μία στην άλλη και δεν υπάρχει λόγος να πούμε ότι οποιαδήποτε δομή θα πρέπει να επικρατεί στο υγρό νερό.
Οι δομικές μελέτες του νερού μπορούν να μελετηθούν χρησιμοποιώντας διαφορετικές μεθόδους.φασματοσκοπία μαγνητικού συντονισμού πρωτονίων, φασματοσκοπία υπέρυθρων, περίθλαση ακτίνων Χ κ.λπ. Για παράδειγμα, η περίθλαση ακτίνων Χ και νετρονίων έχει μελετηθεί πολλές φορές. Ωστόσο, αυτά τα πειράματα δεν μπορούν να παρέχουν λεπτομερείς πληροφορίες για τη δομή. Οι ανομοιογένειες που διαφέρουν ως προς την πυκνότητα μπορούν να φανούν από τη σκέδαση ακτίνων Χ και νετρονίων σε μικρές γωνίες, αλλά αυτές οι ανομοιογένειες πρέπει να είναι μεγάλες, αποτελούμενες από εκατοντάδες μόρια νερού. Θα ήταν δυνατό να τα δούμε μελετώντας τη σκέδαση του φωτός. Ωστόσο, το νερό είναι ένα εξαιρετικά διαυγές υγρό. Το μόνο αποτέλεσμα των πειραμάτων περίθλασης είναι η συνάρτηση ακτινικής κατανομής, δηλαδή η απόσταση μεταξύ των ατόμων οξυγόνου, υδρογόνου και οξυγόνου-υδρογόνου. Είναι σαφές από αυτά ότι δεν υπάρχει σειρά μακράς εμβέλειας στη διάταξη των μορίων του νερού. Αυτές οι λειτουργίες διασπώνται πολύ πιο γρήγορα για το νερό από ό,τι για τα περισσότερα άλλα υγρά. Για παράδειγμα, η κατανομή των αποστάσεων μεταξύ των ατόμων οξυγόνου σε θερμοκρασίες κοντά στη θερμοκρασία δωματίου δίνει μόνο τρία μέγιστα, στα 2,8, 4,5 και 6,7. Το πρώτο μέγιστο αντιστοιχεί στην απόσταση από τους πλησιέστερους γείτονες και η τιμή του είναι περίπου ίση με το μήκος του δεσμού υδρογόνου. Το δεύτερο μέγιστο είναι κοντά στο μέσο μήκος μιας ακμής τετραέδρου: θυμηθείτε ότι τα μόρια του νερού στον εξαγωνικό πάγο βρίσκονται κατά μήκος των κορυφών ενός τετραέδρου που περιγράφεται γύρω από το κεντρικό μόριο. Και το τρίτο μέγιστο, πολύ ασθενώς εκφρασμένο, αντιστοιχεί στην απόσταση από τρίτους και πιο απομακρυσμένους γείτονες στο δίκτυο υδρογόνου. Αυτό το μέγιστο από μόνο του δεν είναι πολύ φωτεινό και δεν χρειάζεται να μιλήσουμε για περαιτέρω κορυφές. Έχουν γίνει προσπάθειες να ληφθούν πιο λεπτομερείς πληροφορίες από αυτές τις διανομές. Έτσι το 1969, ο I.S. Andrianov και ο I.Z. Fisher βρήκαν τις αποστάσεις μέχρι τον όγδοο γείτονα, ενώ στον πέμπτο γείτονα ήταν 3 και στον έκτο 3.1. Αυτό καθιστά δυνατή τη λήψη δεδομένων για το μακρινό περιβάλλον των μορίων του νερού.
Μια άλλη μέθοδος μελέτης της δομής - η περίθλαση νετρονίων σε κρυστάλλους νερού - πραγματοποιείται με τον ίδιο ακριβώς τρόπο όπως η περίθλαση ακτίνων Χ. Ωστόσο, λόγω του γεγονότος ότι τα μήκη σκέδασης νετρονίων δεν διαφέρουν τόσο πολύ μεταξύ διαφορετικών ατόμων, η μέθοδος της ισομορφικής υποκατάστασης καθίσταται απαράδεκτη. Στην πράξη, συνήθως εργάζεται κανείς με έναν κρύσταλλο του οποίου η μοριακή δομή έχει ήδη προσδιοριστεί κατά προσέγγιση με άλλες μεθόδους. Στη συνέχεια μετρώνται οι εντάσεις περίθλασης νετρονίων για αυτόν τον κρύσταλλο. Με βάση αυτά τα αποτελέσματα, πραγματοποιείται μετασχηματισμός Fourier, κατά τον οποίο χρησιμοποιούνται οι μετρούμενες εντάσεις και φάσεις νετρονίων, που υπολογίζονται λαμβάνοντας υπόψη άτομα μη υδρογόνου, δηλ. άτομα οξυγόνου, η θέση των οποίων στο μοντέλο δομής είναι γνωστή. Στη συνέχεια, στον χάρτη Fourier που λαμβάνεται με αυτόν τον τρόπο, τα άτομα υδρογόνου και δευτερίου αναπαρίστανται με πολύ μεγαλύτερα βάρη από ό,τι στον χάρτη πυκνότητας ηλεκτρονίων, επειδή η συμβολή αυτών των ατόμων στη σκέδαση νετρονίων είναι πολύ μεγάλη. Χρησιμοποιώντας αυτόν τον χάρτη πυκνότητας, μπορείτε, για παράδειγμα, να προσδιορίσετε τις θέσεις των ατόμων υδρογόνου (αρνητική πυκνότητα) και του δευτερίου (θετική πυκνότητα).
Είναι δυνατή μια παραλλαγή αυτής της μεθόδου, η οποία συνίσταται στο γεγονός ότι ο κρύσταλλος που σχηματίζεται στο νερό διατηρείται σε βαρύ νερό πριν από τις μετρήσεις. Σε αυτή την περίπτωση, η περίθλαση νετρονίων όχι μόνο καθιστά δυνατό τον προσδιορισμό του πού βρίσκονται τα άτομα υδρογόνου, αλλά προσδιορίζει επίσης εκείνα που μπορούν να ανταλλάσσονται με δευτέριο, κάτι που είναι ιδιαίτερα σημαντικό κατά τη μελέτη της ανταλλαγής ισοτόπων (H-D). Τέτοιες πληροφορίες βοηθούν να επιβεβαιωθεί ότι η δομή έχει δημιουργηθεί σωστά.
Άλλες μέθοδοι καθιστούν επίσης δυνατή τη μελέτη της δυναμικής των μορίων του νερού. Αυτά είναι πειράματα σχετικά με τη σχεδόν ελαστική σκέδαση νετρονίων, την υπερταχεία φασματοσκοπία IR και τη μελέτη της διάχυσης του νερού χρησιμοποιώντας NMR ή επισημασμένα άτομα δευτερίου. Η μέθοδος φασματοσκοπίας NMR βασίζεται στο γεγονός ότι ο πυρήνας ενός ατόμου υδρογόνου έχει μια μαγνητική ροπή - σπιν - που αλληλεπιδρά με τα μαγνητικά πεδία, σταθερή και μεταβλητή. Από το φάσμα NMR μπορεί κανείς να κρίνει σε ποιο περιβάλλον βρίσκονται αυτά τα άτομα και οι πυρήνες, λαμβάνοντας έτσι πληροφορίες για τη δομή του μορίου.
Ως αποτέλεσμα πειραμάτων σχετικά με την οιονεί ελαστική σκέδαση νετρονίων σε κρυστάλλους νερού, μετρήθηκε η πιο σημαντική παράμετρος - ο συντελεστής αυτοδιάχυσης σε διάφορες πιέσεις και θερμοκρασίες. Για να κρίνουμε τον συντελεστή αυτοδιάχυσης από την οιονεί ελαστική σκέδαση νετρονίων, είναι απαραίτητο να κάνουμε μια υπόθεση για τη φύση της μοριακής κίνησης. Εάν κινούνται σύμφωνα με το μοντέλο του Ya.I. Frenkel (διάσημος Ρώσος θεωρητικός φυσικός, συγγραφέας της «Κινητικής Θεωρίας των Υγρών» - ένα κλασικό βιβλίο μεταφρασμένο σε πολλές γλώσσες), που ονομάζεται επίσης μοντέλο «άλμα αναμονής», τότε ο χρόνος της καθιζημένης ζωής (ο χρόνος μεταξύ του άλματος) ενός μορίου είναι 3,2 picoseconds. Οι πιο πρόσφατες μέθοδοι φασματοσκοπίας λέιζερ femtosecond κατέστησαν δυνατή την εκτίμηση της διάρκειας ζωής ενός σπασμένου δεσμού υδρογόνου: χρειάζεται ένα πρωτόνιο 200 fs για να βρεθεί ένας συνεργάτης. Ωστόσο, όλες αυτές είναι μέσες τιμές. Είναι δυνατό να μελετηθούν οι λεπτομέρειες της δομής και της φύσης της κίνησης των μορίων του νερού μόνο με τη βοήθεια προσομοίωσης υπολογιστή, που μερικές φορές ονομάζεται αριθμητικό πείραμα.

Έτσι μοιάζει η δομή του νερού σύμφωνα με τα αποτελέσματα της υπολογιστικής μοντελοποίησης (σύμφωνα με τον Διδάκτωρ Χημικών Επιστημών G.G. Malenkov). Η γενική διαταραγμένη δομή μπορεί να χωριστεί σε δύο τύπους περιοχών (που παρουσιάζονται ως σκοτεινές και ανοιχτόχρωμες μπάλες), οι οποίες διαφέρουν ως προς τη δομή τους, για παράδειγμα, στον όγκο του πολύεδρου Voronoi (a), στον βαθμό της τετραεδρικότητας του άμεσου περιβάλλοντος ( β), την τιμή της δυναμικής ενέργειας (c), και επίσης με την παρουσία τεσσάρων δεσμών υδρογόνου σε κάθε μόριο (d). Ωστόσο, αυτές οι περιοχές κυριολεκτικά σε μια στιγμή, μετά από μερικά πικοδευτερόλεπτα, θα αλλάξουν τη θέση τους.
Η προσομοίωση γίνεται έτσι. Η δομή του πάγου λαμβάνεται και θερμαίνεται μέχρι να λιώσει. Στη συνέχεια, μετά από κάποιο χρονικό διάστημα για να ξεχάσει το νερό την κρυσταλλική του προέλευση, λαμβάνονται στιγμιαίες μικροφωτογραφίες.
Για την ανάλυση της δομής του νερού, επιλέγονται τρεις παράμετροι:
- βαθμός απόκλισης του τοπικού περιβάλλοντος του μορίου από τις κορυφές ενός κανονικού τετραέδρου.
-δυνητική ενέργεια μορίων.
-ο όγκος του λεγόμενου πολύεδρου Voronoi.
Για να κατασκευάσετε αυτό το πολύεδρο, πάρτε μια ακμή από ένα δεδομένο μόριο στο πλησιέστερο, χωρίστε το στη μέση και σχεδιάστε ένα επίπεδο μέσα από αυτό το σημείο κάθετο στην άκρη. Αυτό δίνει τον όγκο ανά μόριο. Ο όγκος ενός πολυεδρικού είναι η πυκνότητα, η τετραεδρία είναι ο βαθμός παραμόρφωσης των δεσμών υδρογόνου, η ενέργεια είναι ο βαθμός σταθερότητας της μοριακής διαμόρφωσης. Τα μόρια με παρόμοιες τιμές καθεμιάς από αυτές τις παραμέτρους τείνουν να ομαδοποιούνται σε ξεχωριστές ομάδες. Και οι δύο περιοχές χαμηλής και υψηλής πυκνότητας έχουν διαφορετικές ενεργειακές τιμές, αλλά μπορούν επίσης να έχουν τις ίδιες ενεργειακές τιμές. Πειράματα έδειξαν ότι περιοχές με διαφορετικές δομές, συστάδες προκύπτουν αυθόρμητα και αποσυντίθενται αυθόρμητα. Ολόκληρη η δομή του νερού είναι ζωντανή και συνεχώς μεταβάλλεται, και ο χρόνος κατά τον οποίο συμβαίνουν αυτές οι αλλαγές είναι πολύ σύντομος. Οι ερευνητές παρακολούθησαν τις κινήσεις των μορίων και διαπίστωσαν ότι εκτελούσαν ακανόνιστες δονήσεις με συχνότητα περίπου 0,5 ps και πλάτος 1 angstrom. Παρατηρήθηκαν επίσης σπάνια αργά άλματα angstroms που διαρκούν για picoseconds. Γενικά, σε 30 ps ένα μόριο μπορεί να κινήσει 8-10 angstroms. Η διάρκεια ζωής του τοπικού περιβάλλοντος είναι επίσης μικρή. Οι περιοχές που αποτελούνται από μόρια με παρόμοιες τιμές όγκου του πολυέδρου Voronoi μπορούν να διασπαστούν σε 0,5 ps ή μπορούν να ζήσουν για αρκετά picosecond. Αλλά η κατανομή των ζωών του δεσμού υδρογόνου είναι πολύ μεγάλη. Αλλά αυτός ο χρόνος δεν υπερβαίνει τα 40 ps και η μέση τιμή είναι αρκετά ps.
Συμπερασματικά, πρέπει να τονιστεί ότι Η θεωρία της δομής συστάδας του νερού έχει πολλές παγίδες.Για παράδειγμα, ο Ζενίν προτείνει ότι το κύριο δομικό στοιχείο του νερού είναι ένα σύμπλεγμα 57 μορίων που σχηματίζεται από τη σύντηξη τεσσάρων δωδεκαέδρων. Έχουν κοινά πρόσωπα και τα κέντρα τους σχηματίζουν ένα κανονικό τετράεδρο. Είναι από καιρό γνωστό ότι τα μόρια του νερού μπορούν να βρίσκονται στις κορυφές ενός πενταγωνικού δωδεκαέδρου. Ένα τέτοιο δωδεκάεδρο είναι η βάση των ένυδρων αερίων. Επομένως, δεν υπάρχει τίποτα περίεργο στην υπόθεση της ύπαρξης τέτοιων δομών στο νερό, αν και έχει ήδη ειπωθεί ότι καμία συγκεκριμένη δομή δεν μπορεί να κυριαρχεί και να υπάρχει για μεγάλο χρονικό διάστημα. Είναι λοιπόν περίεργο ότι αυτό το στοιχείο θεωρείται ότι είναι το κύριο και ότι περιέχει ακριβώς 57 μόρια. Από μπάλες, για παράδειγμα, μπορείτε να συναρμολογήσετε τις ίδιες δομές, οι οποίες αποτελούνται από δωδεκάεδρα γειτονικά μεταξύ τους και περιέχουν 200 μόρια. Ο Ζενίν ισχυρίζεται ότι η διαδικασία του τρισδιάστατου πολυμερισμού του νερού σταματά στα 57 μόρια. Κατά τη γνώμη του, δεν πρέπει να υπάρχουν μεγαλύτεροι συνεργάτες. Ωστόσο, εάν ήταν έτσι, οι εξαγωνικοί κρύσταλλοι πάγου, που περιέχουν έναν τεράστιο αριθμό μορίων συνδεδεμένων μεταξύ τους με δεσμούς υδρογόνου, δεν θα μπορούσαν να κατακρημνιστούν από τους υδρατμούς. Δεν είναι καθόλου σαφές γιατί η ανάπτυξη του συμπλέγματος Ζενίν σταμάτησε στα 57 μόρια. Για να αποφευχθούν οι αντιφάσεις, το Ζενίν συσκευάζει σμήνη σε πιο πολύπλοκους σχηματισμούς - ρομβοέδρα - σχεδόν χιλίων μορίων και τα αρχικά σμήνη δεν σχηματίζουν δεσμούς υδρογόνου μεταξύ τους. Γιατί; Σε τι διαφέρουν τα μόρια στην επιφάνειά τους από αυτά που βρίσκονται μέσα; Σύμφωνα με τον Zenin, το σχέδιο των υδροξυλομάδων στην επιφάνεια των ρομβοέδρων παρέχει τη μνήμη του νερού. Κατά συνέπεια, τα μόρια του νερού σε αυτά τα μεγάλα σύμπλοκα είναι άκαμπτα σταθερά και τα ίδια τα σύμπλοκα είναι στερεά. Αυτό το νερό δεν θα ρέει και το σημείο τήξης του, που σχετίζεται με το μοριακό βάρος, θα πρέπει να είναι πολύ υψηλό.
Ποιες ιδιότητες του νερού εξηγεί το μοντέλο του Zenin; Δεδομένου ότι το μοντέλο βασίζεται σε τετραεδρικές δομές, μπορεί να είναι περισσότερο ή λιγότερο συνεπές με δεδομένα περίθλασης ακτίνων Χ και νετρονίων. Ωστόσο, είναι απίθανο το μοντέλο να μπορεί να εξηγήσει τη μείωση της πυκνότητας κατά την τήξη· η συσσώρευση των δωδεκαέδρων είναι λιγότερο πυκνή από τον πάγο. Αλλά είναι πολύ δύσκολο να συμφωνήσουμε με ένα μοντέλο με δυναμικές ιδιότητες - ρευστότητα, μεγάλη τιμή του συντελεστή αυτοδιάχυσης, σύντομους χρόνους συσχέτισης και διηλεκτρικής χαλάρωσης, που μετρώνται σε picoseconds.
Ph.D. O.V. Mosin
Βιβλιογραφικές αναφορές:
Γ.Γ. Malenkov. Advances in Physical Chemistry, 2001
S.V.Zenin, Β.Μ. Polanuer, B.V. Tyaglov. Πειραματική απόδειξη της παρουσίας υδάτινων κλασμάτων. Ζ. Ομοιοπαθητική ιατρική και βελονισμός. 1997.Αρ.2.Σ.42-46.
S.V. Zenin, B.V. Tyaglov. Υδροφοβικό μοντέλο της δομής των συνεργατών των μορίων του νερού. J. Physical Chemistry, 1994. Τ. 68. Νο. 4. Ρ. 636-641.
S.V. Ζενίν Μελέτη της δομής του νερού με τη μέθοδο του μαγνητικού συντονισμού πρωτονίων. Dokl.RAN.1993.T.332.No.3.S.328-329.
S.V.Zenin, B.V.Tyaglov. Η φύση της υδρόφοβης αλληλεπίδρασης. Η εμφάνιση πεδίων προσανατολισμού σε υδατικά διαλύματα. J. Physical Chemistry, 1994. Τ. 68. Νο. 3. Ρ. 500-503.
S.V. Zenin, B.V. Tyaglov, G.B. Sergeev, Z.A. Shabarova. Μελέτη ενδομοριακών αλληλεπιδράσεων σε νουκλεοτιδαμίδια με χρήση NMR. Υλικά 2ης Πανενωσιακής Συνόδου. Με δυναμική Στερεοχημεία. Οδησσός.1975.σ.53.
S.V. Ζενίν. Η δομημένη κατάσταση του νερού ως βάση για τον έλεγχο της συμπεριφοράς και της ασφάλειας των ζωντανών συστημάτων. ΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ. Διδάκτωρ Βιολογικών Επιστημών. Κρατικό Επιστημονικό Κέντρο «Ινστιτούτο Ιατρικών και Βιολογικών Προβλημάτων» (SSC «IMBP»). Protected 1999. 05. 27. UDC 577.32:57.089.001.66.207 σελ.
ΣΕ ΚΑΙ. Slesarev. Έκθεση προόδου της έρευνας
Κρατικό Πανεπιστήμιο του Ταμπόφ που πήρε το όνομά του. G.R. Derzhavina
Εκπαιδευτική Εφημερίδα Soros, Τόμος 6, Αρ. 9, 2000
Νερό και πάγος: γνωρίζουμε αρκετά για αυτά;
Yu. Ι. ΓΚΟΛΟΒΙΝ
Περιγράφονται οι φυσικές ιδιότητες του νερού και του πάγου. Συζητούνται μηχανισμοί διαφόρων φαινομένων σε αυτές τις ουσίες. Παρά τη μακρά περίοδο μελέτης και την απλή χημική σύνθεση, το νερό και ο πάγος –οι ουσίες είναι εξαιρετικά πολύτιμες για τη ζωή στη γη– φιλοξενούν πολλά μυστήρια λόγω της περίπλοκης δυναμικής δομής πρωτονίων και μοριακών δομών τους.Δίνεται μια σύντομη επισκόπηση των φυσικών ιδιοτήτων του νερού και του πάγου. Εξετάζονται οι μηχανισμοί των διαφόρων φαινομένων σε αυτά. Αποδεικνύεται ότι, παρά την αιωνόβια ιστορία μελέτης, την απλούστερη χημική σύνθεση και την εξαιρετική σημασία για τη ζωή στη Γη, η φύση του νερού και του πάγου είναι γεμάτη με πολλά μυστήρια λόγω της πολύπλοκης δυναμικής δομής πρωτονίων και μοριακών δομών.
Αν και οι άνθρωποι χρειάζονται περισσότερο την απλότητα,
Ωστόσο, το σύμπλεγμα τους είναι πιο ξεκάθαρο.
B.L. Είδος δαυκίου
Ίσως δεν υπάρχει πιο διαδεδομένη και ταυτόχρονα πιο μυστηριώδης ουσία στη Γη από το νερό στην υγρή και τη στερεή φάση. Πράγματι, αρκεί να θυμόμαστε ότι όλα τα έμβια όντα προέρχονται από νερό και αποτελούνται από περισσότερο από το 50% αυτού, ότι το 71% της επιφάνειας της Γης καλύπτεται με νερό και πάγο και ένα σημαντικό μέρος των βόρειων χερσαίων περιοχών είναι μόνιμος παγωμένος. Για να απεικονίσουμε τη συνολική ποσότητα πάγου στον πλανήτη μας, σημειώνουμε ότι εάν λιώσουν, το νερό στον Παγκόσμιο Ωκεανό θα ανέβει περισσότερο από 50 μέτρα, γεγονός που θα οδηγήσει στην πλημμύρα γιγάντιων χερσαίων περιοχών σε όλο τον κόσμο. Τεράστιες μάζες πάγου έχουν ανακαλυφθεί στο Σύμπαν, συμπεριλαμβανομένου του Ηλιακού Συστήματος. Δεν υπάρχει ούτε μία, περισσότερο ή λιγότερο σημαντική παραγωγή ή ανθρώπινη δραστηριότητα στην οποία να μην χρησιμοποιείται νερό. Τις τελευταίες δεκαετίες, έχουν ανακαλυφθεί μεγάλα αποθέματα καυσίμου με τη μορφή στερεών υδριτών που μοιάζουν με πάγο φυσικών υδρογονανθράκων.
Ταυτόχρονα, μετά από πολλές επιτυχίες στη φυσική και τη φυσική χημεία του νερού τα τελευταία χρόνια, δύσκολα μπορεί να υποστηριχθεί ότι οι ιδιότητες αυτής της απλής ουσίας είναι απολύτως κατανοητές και προβλέψιμες. Αυτό το άρθρο παρέχει μια σύντομη επισκόπηση των πιο σημαντικών φυσικών ιδιοτήτων του νερού και του πάγου και άλυτα προβλήματα που σχετίζονται κυρίως με τη φυσική των καταστάσεων χαμηλής θερμοκρασίας τους.
Αυτό είναι ένα πολύπλοκο μόριο
Τα θεμέλια της σύγχρονης κατανόησης της φυσικής χημείας του νερού τέθηκαν πριν από περίπου 200 χρόνια από τους Henry Cavendish και Antoine Lavoisier, οι οποίοι ανακάλυψαν ότι το νερό δεν είναι ένα απλό χημικό στοιχείο, όπως πίστευαν οι αλχημιστές του Μεσαίωνα, αλλά μια ένωση οξυγόνου και υδρογόνου σε ορισμένη αναλογία. Στην πραγματικότητα, το υδρογόνο (υδρογόνο) - που γεννά το νερό - έλαβε το όνομά του μόνο μετά από αυτή την ανακάλυψη και το νερό απέκτησε τη σύγχρονη χημική ονομασία του, γνωστή πλέον σε κάθε μαθητή - H 2 O.
Έτσι, το μόριο H 2 O είναι κατασκευασμένο από δύο άτομα υδρογόνου και ένα άτομο οξυγόνου. Όπως προκύπτει από μελέτες των οπτικών φασμάτων του νερού, σε μια υποθετική κατάσταση πλήρους απουσίας κίνησης (χωρίς ταλαντώσεις και περιστροφές), τα ιόντα υδρογόνου και οξυγόνου θα πρέπει να καταλαμβάνουν θέσεις στις κορυφές ενός ισοσκελούς τριγώνου με γωνία στην κορυφή που καταλαμβάνεται από το οξυγόνο 104,5° (Εικ. 1, α). Στη μη διεγερμένη κατάσταση, οι αποστάσεις μεταξύ των ιόντων H + και O 2− είναι 0,96 Å. Χάρη σε αυτή τη δομή, το μόριο του νερού είναι δίπολο, καθώς η πυκνότητα ηλεκτρονίων στην περιοχή όπου βρίσκεται το ιόν O 2− είναι σημαντικά υψηλότερη από ό,τι στην περιοχή των ιόντων H + και το απλούστερο μοντέλο - το μοντέλο των σφαιρών - δεν είναι κατάλληλο για την περιγραφή των ιδιοτήτων του νερού. Μπορείτε να φανταστείτε ένα μόριο νερού σε μορφή μπάλας με δύο μικρές διογκώσεις στην περιοχή όπου βρίσκονται τα πρωτόνια (Εικ. 1, β). Ωστόσο, αυτό δεν βοηθά στην κατανόηση ενός άλλου χαρακτηριστικού του νερού - της ικανότητας σχηματισμού κατευθυνόμενων δεσμών υδρογόνου μεταξύ μορίων, που παίζουν τεράστιο ρόλο στο σχηματισμό της χαλαρής, αλλά ταυτόχρονα πολύ σταθερής χωρικής δομής του, που καθορίζει το μεγαλύτερο μέρος του φυσικές ιδιότητες τόσο σε υγρή όσο και σε στερεή κατάσταση.
Ρύζι. 1.Γεωμετρικό διάγραμμα (α), επίπεδο μοντέλο (β) και χωρική ηλεκτρονική δομή (γ) του μονομερούς H 2 O. Δύο από τα τέσσερα ηλεκτρόνια στο εξωτερικό περίβλημα του ατόμου οξυγόνου εμπλέκονται στη δημιουργία ομοιοπολικών δεσμών με άτομα υδρογόνου και άλλα δύο σχηματίζουν πολύ επιμήκεις τροχιές ηλεκτρονίων, επίπεδο που είναι κάθετο στο επίπεδο H–O–H
Ας θυμηθούμε ότι ένας δεσμός υδρογόνου είναι ένας δεσμός μεταξύ ατόμων ενός μορίου ή γειτονικών μορίων που εμφανίζεται μέσω ενός ατόμου υδρογόνου. Καταλαμβάνει μια ενδιάμεση θέση μεταξύ ενός ομοιοπολικού και ενός μη σθενούς δεσμού και σχηματίζεται όταν ένα άτομο υδρογόνου βρίσκεται ανάμεσα σε δύο ηλεκτραρνητικά άτομα (Ο, Ν, F κ.λπ.). Το ηλεκτρόνιο στο άτομο Η είναι σχετικά ασθενώς συνδεδεμένο με το πρωτόνιο, επομένως η μέγιστη πυκνότητα ηλεκτρονίων μετατοπίζεται σε ένα πιο ηλεκτραρνητικό άτομο και το πρωτόνιο εκτίθεται και αρχίζει να αλληλεπιδρά με ένα άλλο ηλεκτραρνητικό άτομο. Σε αυτήν την περίπτωση, τα άτομα O⋅⋅⋅O, N⋅⋅⋅O κ.λπ., έρχονται πιο κοντά μεταξύ τους. σε απόσταση κοντά σε αυτή που θα δημιουργούσε μεταξύ τους απουσία του ατόμου Η. Ο δεσμός υδρογόνου καθορίζει όχι μόνο τη δομή του νερού, αλλά παίζει επίσης έναν εξαιρετικά σημαντικό ρόλο στη ζωή των βιομορίων: πρωτεΐνες, υδατάνθρακες, νουκλεϊκά οξέα κ.λπ. .
Προφανώς, για να εξηγηθεί η φύση του νερού είναι απαραίτητο να ληφθεί υπόψη η ηλεκτρονική δομή των μορίων του. Όπως γνωρίζετε, το άτομο οξυγόνου έχει τέσσερα ηλεκτρόνια στο ανώτερο περίβλημά του, ενώ το υδρογόνο έχει μόνο ένα ηλεκτρόνιο. Ο σχηματισμός κάθε ομοιοπολικού δεσμού Ο-Η περιλαμβάνει ένα ηλεκτρόνιο από τα άτομα οξυγόνου και υδρογόνου. Τα δύο ηλεκτρόνια που παραμένουν στο οξυγόνο ονομάζονται μοναχικό ζεύγος, αφού σε ένα απομονωμένο μόριο νερού παραμένουν ελεύθερα, χωρίς να συμμετέχουν στο σχηματισμό δεσμών μέσα στο μόριο H 2 O. Αλλά όταν πλησιάζουν άλλα μόρια, είναι αυτά τα μόνα ηλεκτρόνια που παίζουν ένα καθοριστικό ρόλο στη διαμόρφωση της μοριακής δομής του νερού .
Τα μεμονωμένα ηλεκτρόνια απωθούνται από δεσμούς Ο-Η, επομένως οι τροχιές τους επιμηκύνονται έντονα προς την αντίθετη κατεύθυνση από τα άτομα του υδρογόνου και τα τροχιακά επίπεδα περιστρέφονται σε σχέση με το επίπεδο που σχηματίζεται από τους δεσμούς Ο-Η-Ο. Έτσι, θα ήταν πιο σωστό να απεικονίσουμε ένα μόριο νερού σε τρισδιάστατο χώρο συντεταγμένων xyzμε τη μορφή ενός τετραέδρου, στο κέντρο του οποίου υπάρχει ένα άτομο οξυγόνου, και σε δύο κορυφές υπάρχει ένα άτομο υδρογόνου (Εικ. 1, γ). Η ηλεκτρονική δομή των μορίων H 2 O καθορίζει τις συνθήκες για τη σύνδεσή τους σε ένα σύνθετο τρισδιάστατο δίκτυο δεσμών υδρογόνου τόσο στο νερό όσο και στον πάγο. Κάθε ένα από τα πρωτόνια μπορεί να σχηματίσει έναν δεσμό με ένα μόνο ηλεκτρόνιο ενός άλλου μορίου. Το πρώτο μόριο δρα ως δέκτης και το δεύτερο ως δότης, σχηματίζοντας δεσμό υδρογόνου. Επειδή κάθε μόριο H2O έχει δύο πρωτόνια και δύο μόνα ηλεκτρόνια, μπορεί να σχηματίσει τέσσερις δεσμούς υδρογόνου με άλλα μόρια ταυτόχρονα. Έτσι, το νερό είναι ένα σύνθετο συνδεδεμένο υγρό με δυναμική φύση συνδέσεων και η περιγραφή των ιδιοτήτων του σε μοριακό επίπεδο είναι δυνατή μόνο με τη βοήθεια κβαντομηχανικών μοντέλων διαφορετικών βαθμών πολυπλοκότητας και αυστηρότητας.
Ο πάγος και οι ιδιότητές του
Από την άποψη του μέσου ανθρώπου, ο πάγος είναι λίγο-πολύ ο ίδιος ανεξάρτητα από το πού σχηματίζεται: στην ατμόσφαιρα ως χαλάζι, στις άκρες των στεγών ως παγάκια ή στα υδάτινα σώματα ως πλάκες. Από φυσική άποψη, υπάρχουν πολλές ποικιλίες πάγου, που διαφέρουν ως προς τη μοριακή και μεσοσκοπική τους δομή. Στον πάγο που υπάρχει σε κανονική πίεση, κάθε μόριο H 2 O περιβάλλεται από άλλα τέσσερα, δηλαδή ο αριθμός συντονισμού της δομής είναι τέσσερις (ο λεγόμενος πάγος I h). Το αντίστοιχο κρυσταλλικό πλέγμα - εξαγωνικό - δεν είναι κλειστό, επομένως η πυκνότητα του συνηθισμένου πάγου (~0,9 g/cm 3) είναι μικρότερη από την πυκνότητα του νερού (~1 g/cm 3), για τη δομή του οποίου, όπως Οι μελέτες περίθλασης ακτίνων Χ δείχνουν ότι ο μέσος αριθμός συντονισμού είναι ~ 4,4 (έναντι 4 για πάγο I h). Μόνο τα άτομα οξυγόνου καταλαμβάνουν σταθερές θέσεις στη δομή του πάγου. Δύο άτομα υδρογόνου μπορούν να καταλάβουν διαφορετικές θέσεις στους τέσσερις δεσμούς του μορίου H 2 O με άλλους γείτονες. Λόγω της εξαγωνικότητας του πλέγματος, οι κρύσταλλοι που αναπτύσσονται σε ελεύθερη κατάσταση (για παράδειγμα, οι νιφάδες χιονιού) έχουν εξαγωνικό σχήμα.
Ωστόσο, η εξαγωνική φάση απέχει πολύ από τη μοναδική μορφή ύπαρξης πάγου. Ο ακριβής αριθμός άλλων κρυσταλλικών φάσεων - πολυμορφικών μορφών πάγου - είναι ακόμα άγνωστος. Σχηματίζονται σε υψηλές πιέσεις και χαμηλές θερμοκρασίες (Εικ. 2). Ορισμένοι ερευνητές θεωρούν την παρουσία 12 τέτοιων φάσεων ως επακριβώς τεκμηριωμένη, ενώ άλλοι τις υπολογίζουν μέχρι 14. Φυσικά, αυτή δεν είναι η μόνη ουσία που έχει πολυμορφισμό (θυμηθείτε, για παράδειγμα, γραφίτη και διαμάντι, που αποτελούνται από χημικά πανομοιότυπα άτομα άνθρακα ), αλλά ο αριθμός των διαφορετικών φάσεων του πάγου, που συνεχίζουν να ανακαλύπτονται μέχρι σήμερα, είναι εκπληκτικός. Όλα τα παραπάνω σχετίζονται με τη διατεταγμένη διάταξη των ιόντων οξυγόνου στο κρυσταλλικό πλέγμα του πάγου. Όσον αφορά τα πρωτόνια - ιόντα υδρογόνου - όπως φαίνεται από την περίθλαση νετρονίων, υπάρχει έντονη διαταραχή στη διάταξή τους. Έτσι, ο κρυσταλλικός πάγος είναι ταυτόχρονα ένα καλά διατεταγμένο μέσο (σε σχέση με το οξυγόνο) και ταυτόχρονα ένα διαταραγμένο μέσο (σε σχέση με το υδρογόνο).

Ρύζι. 2.Διάγραμμα φάσης κρυσταλλικού πάγου.
Οι ρωμαϊκοί αριθμοί υποδεικνύουν περιοχές ύπαρξης
σχηματισμός σταθερών φάσεων. Το Ice IV είναι ένα μετασταθερό φον
for, που βρίσκεται στο διάγραμμα μέσα στην περιοχή V
Συχνά φαίνεται ότι ο πάγος είναι ελατός και ρευστός. Αυτό ισχύει εάν η θερμοκρασία είναι κοντά στο σημείο τήξης (δηλαδή t = 0°C σε ατμοσφαιρική πίεση) και το φορτίο εφαρμόζεται για μεγάλο χρονικό διάστημα. Και το πιο σκληρό υλικό (για παράδειγμα, μέταλλο) σε θερμοκρασίες κοντά στο σημείο τήξης συμπεριφέρεται με παρόμοιο τρόπο. Η πλαστική παραμόρφωση του πάγου, καθώς και πολλών άλλων κρυσταλλικών στερεών, συμβαίνει ως αποτέλεσμα της πυρήνωσης και της κίνησης διαφόρων δομικών ατελειών μέσω του κρυστάλλου: κενά, ενδιάμεσα άτομα, όρια κόκκων και, το πιο σημαντικό, εξαρθρώσεις. Όπως διαπιστώθηκε στη δεκαετία του '30 του αιώνα μας, η παρουσία του τελευταίου είναι που προκαθορίζει μια απότομη μείωση της αντοχής των κρυσταλλικών στερεών στην πλαστική παραμόρφωση (κατά 10 2 – 10 4 φορές σε σχέση με την αντίσταση ενός ιδανικού πλέγματος). Μέχρι σήμερα, όλοι οι τύποι εξαρθρώσεων που χαρακτηρίζουν την εξαγωνική δομή έχουν ανακαλυφθεί στον πάγο Ih και έχουν μελετηθεί τα μικρομηχανικά και ηλεκτρικά τους χαρακτηριστικά.
Η επίδραση του ρυθμού παραμόρφωσης στις μηχανικές ιδιότητες του μονοκρυσταλλικού πάγου φαίνεται καλά στο Σχ. 3, βγαλμένο από το βιβλίο του N. Maeno. Μπορεί να φανεί ότι με την αύξηση του ρυθμού παραμόρφωσης, οι μηχανικές τάσεις σ που απαιτούνται για τη ροή του πλαστικού αυξάνονται γρήγορα και εμφανίζεται ένα γιγάντιο δόντι διαρροής από την εξάρτηση της σχετικής τάσης Ε από το σ.

Ρύζι. 3.(Με ). Καμπύλες παραμόρφωσης σχετικής τάσης για μονοκρύσταλλο πάγου I h σε t = -15°С (ολίσθηση κατά μήκος του βασικού επιπέδου προσανατολισμένου υπό γωνία 45° ως προς τον άξονα συμπίεσης). Οι αριθμοί στις καμπύλες δείχνουν τον σχετικό ρυθμό παραμόρφωσης ( ∆l– αλλαγή στο μήκος του δείγματος μεγάλοστη διάρκεια ∆τ
) σε μονάδες 10 −7 s −1

Ρύζι. 4.Σχέδιο σχηματισμού ελαττωμάτων στο υποσύστημα πρωτονίων του πάγου: α – ένα ζεύγος ιοντικών ελαττωμάτων H 3 O + και OH –; β – ζεύγος προσανατολιστικών ελαττωμάτων Bjerrum D και L
Οι ηλεκτρικές ιδιότητες του πάγου δεν είναι λιγότερο αξιοσημείωτες. Το μέγεθος της αγωγιμότητας και η εκθετικά γρήγορη αύξησή της με την αύξηση της θερμοκρασίας διακρίνουν έντονα τον πάγο από τους μεταλλικούς αγωγούς και τον τοποθετούν στο ίδιο επίπεδο με τους ημιαγωγούς. Ο πάγος είναι συνήθως πολύ χημικά καθαρός, ακόμα κι αν αναπτύσσεται από βρώμικο νερό ή διάλυμα (σκεφτείτε καθαρά, διαφανή κομμάτια πάγου σε μια βρώμικη λακκούβα). Αυτό οφείλεται στη χαμηλή διαλυτότητα των ακαθαρσιών στη δομή του πάγου. Ως αποτέλεσμα, κατά τη διάρκεια της κατάψυξης, οι ακαθαρσίες απομακρύνονται στο μέτωπο κρυστάλλωσης στο υγρό και δεν εισέρχονται στη δομή του πάγου. Γι' αυτό το φρέσκο χιόνι είναι πάντα λευκό και το νερό από αυτό είναι εξαιρετικά καθαρό.
Η φύση έχει παράσχει σοφά έναν γιγάντιο σταθμό καθαρισμού νερού σε όλη την ατμόσφαιρα της Γης. Επομένως, δεν μπορεί κανείς να υπολογίζει σε υψηλή αγωγιμότητα ακαθαρσιών (όπως, για παράδειγμα, στο εμποτισμένο πυρίτιο) στον πάγο. Αλλά δεν υπάρχουν ελεύθερα ηλεκτρόνια σε αυτό, όπως στα μέταλλα. Μόλις στη δεκαετία του '50 του 20ου αιώνα διαπιστώθηκε ότι οι φορείς φορτίου στον πάγο είναι άτακτα πρωτόνια, δηλαδή ο πάγος είναι ένας ημιαγωγός πρωτονίων.
Η άλμα πρωτονίων που αναφέρθηκε παραπάνω δημιουργεί δύο τύπους ελαττωμάτων στη δομή του πάγου: ιοντική και προσανατολιστική (Εικ. 4). Στην πρώτη περίπτωση, εμφανίζεται ένα άλμα πρωτονίου κατά μήκος ενός δεσμού υδρογόνου από ένα μόριο H 2 O σε ένα άλλο (Εικ. 4, α), με αποτέλεσμα το σχηματισμό ενός ζεύγους ιοντικών ελαττωμάτων H 3 O + και OH - και στο δεύτερον - σε έναν γειτονικό δεσμό υδρογόνου σε ένα μόριο H 2 O (Εικ. 4, β), ως αποτέλεσμα του οποίου προκύπτει ένα ζεύγος προσανατολιστικών ελαττωμάτων Bjerrum, που ονομάζονται ελαττώματα L και D (από τα γερμανικά leer - κενό και doppelt - διπλό ). Τυπικά, ένα τέτοιο άλμα μπορεί να θεωρηθεί ως περιστροφή του μορίου H 2 O κατά 120°.
Η ροή συνεχούς ρεύματος λόγω της κίνησης μόνο ιοντικών ή μόνο ελαττωμάτων προσανατολισμού είναι αδύνατη. Εάν, για παράδειγμα, ένα ιόν H 3 O + διέρχεται από κάποιο μέρος του πλέγματος, τότε το επόμενο παρόμοιο ιόν δεν θα μπορεί να περάσει από την ίδια διαδρομή. Ωστόσο, εάν ένα ελάττωμα D περάσει κατά μήκος αυτής της διαδρομής, η διάταξη των πρωτονίων θα επιστρέψει στην αρχική και, ως εκ τούτου, το επόμενο ιόν H 3 O + θα μπορεί να περάσει μέσα από αυτό. Τα ελαττώματα OH - και L συμπεριφέρονται παρόμοια. Επομένως, η ηλεκτρική αγωγιμότητα του χημικά καθαρού πάγου περιορίζεται από εκείνα τα ελαττώματα που είναι μικρότερα σε αριθμό, δηλαδή τα ιοντικά. Η διηλεκτρική πόλωση, αντίθετα, οφείλεται σε πιο πολυάριθμα ελαττώματα προσανατολισμού Bjerrum. Στην πραγματικότητα, όταν εφαρμόζεται ένα εξωτερικό ηλεκτρικό πεδίο, και οι δύο διεργασίες συμβαίνουν παράλληλα, γεγονός που επιτρέπει στον πάγο να διεξάγει συνεχές ρεύμα και ταυτόχρονα να παρουσιάζει ισχυρή διηλεκτρική πόλωση, δηλαδή να παρουσιάζει τόσο τις ιδιότητες ενός ημιαγωγού όσο και τις ιδιότητες ενός απομονωτήρας. Τα τελευταία χρόνια, συνεχίστηκαν οι προσπάθειες για την ανακάλυψη των σιδηροηλεκτρικών και πιεζοηλεκτρικών ιδιοτήτων του καθαρού πάγου σε χαμηλές θερμοκρασίες τόσο στο χύμα όσο και στα μεσοφασικά όρια. Δεν υπάρχει ακόμη πλήρης εμπιστοσύνη στην ύπαρξή τους, αν και έχουν ανακαλυφθεί αρκετά ψευδοπιεζοηλεκτρικά φαινόμενα που σχετίζονται με την παρουσία εξαρθρώσεων και άλλων δομικών ελαττωμάτων.
Φυσική επιφάνειας και κρυστάλλωση πάγου
Σε σχέση με την ανάπτυξη της τεχνολογίας ημιαγωγών, τη μικρομικρογραφία της βάσης των στοιχείων και τη μετάβαση σε επίπεδες τεχνολογίες, το ενδιαφέρον για τη φυσική επιφανειών έχει αυξηθεί πολύ την τελευταία δεκαετία. Πολλές εξελιγμένες τεχνικές έχουν αναπτυχθεί για τη μελέτη καταστάσεων κοντά στην επιφάνεια σε στερεά, οι οποίες έχουν αποδειχθεί χρήσιμες στη μελέτη μετάλλων, ημιαγωγών και διηλεκτρικών. Ωστόσο, η δομή και οι ιδιότητες της επιφάνειας του πάγου δίπλα σε ατμό ή υγρό παραμένουν σε μεγάλο βαθμό ασαφείς. Μία από τις πιο ενδιαφέρουσες υποθέσεις, που προτάθηκε από τον M. Faraday, είναι η ύπαρξη στην επιφάνεια του πάγου ενός οιονεί υγρού στρώματος πάχους δεκάδων έως εκατοντάδων angstroms, ακόμη και σε θερμοκρασία πολύ κάτω από το σημείο τήξης. Η βάση για αυτό δεν είναι μόνο οι εικασιακές κατασκευές και οι θεωρίες της δομής των στρωμάτων κοντά στην επιφάνεια των μορίων H 2 O υψηλής πόλωσης, αλλά και οι λεπτοί προσδιορισμοί (με χρήση πυρηνικού μαγνητικού συντονισμού) της κατάστασης φάσης της επιφάνειας του πάγου, καθώς και την επιφανειακή αγωγιμότητα και την εξάρτησή της από τη θερμοκρασία. Ωστόσο, στις περισσότερες πρακτικά σημαντικές περιπτώσεις, οι επιφανειακές ιδιότητες του χιονιού και του πάγου πιθανότατα καθορίζονται από την παρουσία ενός μακροσκοπικού φιλμ νερού παρά από ένα σχεδόν υγρό στρώμα.
Η τήξη των επιφανειακών στρωμάτων του πάγου υπό την επίδραση του ηλιακού φωτός, μιας θερμότερης ατμόσφαιρας ή ενός συμπαγούς σώματος που γλιστράει πάνω του (σαλάχια, σκι, δρομείς ελκήθρου) είναι κρίσιμη για την επίτευξη χαμηλού συντελεστή τριβής. Η χαμηλή τριβή ολίσθησης δεν είναι αποτέλεσμα μείωσης της θερμοκρασίας τήξης υπό την επίδραση αυξημένης πίεσης, όπως συχνά πιστεύεται, αλλά συνέπεια της απελευθέρωσης θερμότητας τριβής. Οι υπολογισμοί δείχνουν ότι η επίδραση της πίεσης, ακόμη και στην περίπτωση ενός απότομα ακονισμένου πατίνι που γλιστράει στον πάγο, κάτω από το οποίο αναπτύσσεται πίεση περίπου 1 MPa, οδηγεί σε μείωση της θερμοκρασίας τήξης μόνο κατά ~0,1°C, η οποία δεν μπορεί να έχει σημαντική επίδραση στην ποσότητα της τριβής.
Μια καθιερωμένη παράδοση στην περιγραφή των ιδιοτήτων του νερού και του πάγου είναι η δήλωση και η συζήτηση πολλών ανώμαλων ιδιοτήτων που διακρίνουν αυτή την ουσία μεταξύ των ομολόγων της (H 2 S, H 2 Se, H 2 Te ). Ίσως το πιο σημαντικό είναι η πολύ υψηλή (μεταξύ απλών ουσιών) ειδική θερμότητα σύντηξης (κρυστάλλωση) και θερμοχωρητικότητα, δηλαδή ο πάγος είναι δύσκολο να λιώσει και το νερό είναι δύσκολο να παγώσει. Ως αποτέλεσμα, το κλίμα στον πλανήτη μας είναι γενικά αρκετά ήπιο, αλλά ελλείψει νερού (για παράδειγμα, στις ερήμους της καυτής Αφρικής), η αντίθεση μεταξύ της θερμοκρασίας ημέρας και νύχτας είναι πολύ υψηλότερη από ό,τι στην ακτή του ωκεανού ταυτόχρονα γεωγραφικό πλάτος. Ζωτικής σημασίας για τη βιόσφαιρα είναι η ιδιότητα να αυξάνεται ο όγκος κατά την κρυστάλλωση και να μην μειώνεται, όπως κάνει η συντριπτική πλειοψηφία των γνωστών ουσιών. Ως αποτέλεσμα, ο πάγος επιπλέει στο νερό αντί να βυθίζεται και επιβραδύνει σημαντικά το πάγωμα των υδάτινων σωμάτων στον κρύο καιρό, προστατεύοντας όλα τα ζωντανά όντα που καταφεύγουν σε αυτό για το χειμώνα. Αυτό διευκολύνεται επίσης από τη μη μονοτονική αλλαγή στην πυκνότητα του νερού όταν η θερμοκρασία πέφτει στους 0°C - μια από τις πιο γνωστές ανώμαλες ιδιότητες του νερού, που ανακαλύφθηκε πριν από περισσότερα από 300 χρόνια. Η μέγιστη πυκνότητα επιτυγχάνεται στους t = 4°C, και αυτό εμποδίζει τα στρώματα νερού που έχουν κρυώσει σε θερμοκρασία κάτω των 4°C να βυθιστούν στον πυθμένα. Η μετααγωγική ανάμιξη του υγρού εμποδίζεται, γεγονός που επιβραδύνει σημαντικά την περαιτέρω ψύξη. Άλλες ανωμαλίες του νερού είναι γνωστές εδώ και πολύ καιρό: ιξώδες διάτμησης στους 20°C, ειδική θερμότητα στους 40°C, ισοθερμική συμπιεστότητα στους 46°C, ταχύτητα ήχου στους 60°C. Το ιξώδες του νερού μειώνεται με την αύξηση της πίεσης και δεν αυξάνεται, όπως άλλα υγρά. Είναι σαφές ότι οι ανώμαλες ιδιότητες του νερού οφείλονται στα δομικά χαρακτηριστικά του μορίου του και στις ιδιαιτερότητες των διαμοριακών αλληλεπιδράσεων. Δεν έχει ακόμη επιτευχθεί πλήρης σαφήνεια σχετικά με το τελευταίο. Οι ιδιότητες που περιγράφονται παραπάνω ισχύουν για το νερό, τον πάγο και τη διεπαφή μεταξύ τους, που υπάρχουν υπό συνθήκες θερμοδυναμικής ισορροπίας. Προβλήματα εντελώς διαφορετικού επιπέδου πολυπλοκότητας προκύπτουν όταν προσπαθούμε να περιγράψουμε τη δυναμική της μετάβασης φάσης νερού-πάγου, ειδικά κάτω από συνθήκες μακριά από τη θερμοδυναμική ισορροπία.
Η θερμοδυναμική αιτία οποιασδήποτε μετάβασης φάσης είναι η διαφορά στα χημικά δυναμικά των σωματιδίων στη μία πλευρά και στην άλλη της διεπαφής ∆µ = µ 1 −µ 2. Το χημικό δυναμικό μ είναι μια συνάρτηση κατάστασης που καθορίζει τις αλλαγές στα θερμοδυναμικά δυναμικά όταν αλλάζει ο αριθμός N των σωματιδίων στο σύστημα, δηλαδή μ = G/N, όπου G = H - TS είναι το θερμοδυναμικό δυναμικό Gibbs, H είναι ενθαλπία, S είναι εντροπία, T είναι θερμοκρασία. Η διαφορά στα θερμοδυναμικά δυναμικά είναι η κινητήρια δύναμη μιας μακροσκοπικής διαδικασίας (όπως ακριβώς η διαφορά στα ηλεκτρικά δυναμικά στα άκρα ενός αγωγού είναι η αιτία του ηλεκτρικού ρεύματος). Στο μ1 = μ2 και οι δύο φάσεις μπορούν να συνυπάρχουν σε ισορροπία για όσο χρονικό διάστημα επιθυμείτε. Σε κανονική πίεση, το χημικό δυναμικό του νερού είναι ίσο με το χημικό δυναμικό του πάγου στους t = 0°C. Στο τ< 0°С более низким химическим потенциалом обладает лед, но это еще не означает, что при любом, самом маленьком переохлаждении начнется кристаллизация. Опыт показывает, что тщательно очищенный от примесей, обезгаженный, деионизированный расплав может быть переохлажден относительно точки равновесия фаз на десятки кельвин (а для некоторых веществ и на сотни). Анализ показывает, что причина заключается в отсутствии зародышей новой фазы (центров кристаллизации, конденсации, парообразования и т.д.).
Τα έμβρυα μπορούν επίσης να σχηματιστούν ομοιογενώς, δηλαδή από το ίδιο το περιβάλλον, το οποίο βρίσκεται σε μετασταθερή κατάσταση, αλλά για αυτό πρέπει να πληρούνται ορισμένες προϋποθέσεις. Ας αρχίσουμε να εξετάζουμε την κατάσταση λαμβάνοντας υπόψη το γεγονός ότι οποιαδήποτε διεπαφή μεταξύ του κρυστάλλου και του τήγματος (ή ατμού, διαλύματος) εισάγει πρόσθετη ενέργεια Sa, όπου S είναι η οριακή περιοχή, α είναι η επιφανειακή ενέργεια. Επιπλέον, τα μόρια Ν που σχημάτισαν τον κρύσταλλο των σπόρων έχουν ενέργεια μικρότερη από ό,τι στο υγρό κατά NΔμ. Ως αποτέλεσμα, η συνολική μεταβολή της ενέργειας στο σύστημα κατά την εμφάνιση ενός πυρήνα ∆U = −N∆µ + Sα θα αποδειχθεί ότι δεν εξαρτάται μονοτονικά από το Ν. Πράγματι, για ένα σφαιρικό σχήμα του πυρήνα
![]()
όπου A = (36πV 2) 1/3 V είναι ο όγκος ανά ένα μόριο στον κρύσταλλο. Από το προηγούμενο προκύπτει ότι η ΔU φτάνει σε μέγιστη ΔUc = - N c ∆µ + AN c 2/3 α, όταν ο πυρήνας περιέχει N c = (2Aα/3∆µ) 3 μόρια.
Έτσι, με τη διαδοχική προσθήκη μορίων στον πυρήνα, το σύστημα πρέπει πρώτα να ανέβει στην κορυφή του δυνητικού λόφου με ύψος ΔU c, ανάλογα με την υπερψύξη, μετά την οποία θα συμβεί περαιτέρω ανάπτυξη του Ν στον κρύσταλλο με μείωση του ενέργεια, δηλαδή πιο εύκολο. Φαίνεται ότι όσο χαμηλότερη είναι η θερμοκρασία του υγρού, δηλαδή όσο ισχυρότερη είναι η υπερψύξη, τόσο πιο γρήγορη κρυστάλλωση θα πρέπει να συμβεί. Αυτό συμβαίνει στην πραγματικότητα όταν η υποθερμία δεν είναι πολύ μεγάλη. Ωστόσο, καθώς το t μειώνεται, το ιξώδες του υγρού αυξάνεται επίσης εκθετικά, καθιστώντας δύσκολη την κίνηση των μορίων. Ως αποτέλεσμα, σε υψηλούς βαθμούς υπερψύξης, η διαδικασία κρυστάλλωσης μπορεί να διαρκέσει για πολλά χρόνια (όπως συμβαίνει με τα ποτήρια διαφόρων προελεύσεων).
Αριθμητικές εκτιμήσεις δείχνουν ότι για νερό σε κανονικούς βαθμούς υπερψύξης σε φυσικές συνθήκες (Δt = 1–10°C), το έμβρυο θα πρέπει να αποτελείται από αρκετές δεκάδες μόρια, τα οποία είναι σημαντικά μεγαλύτερα από τον αριθμό συντονισμού στην υγρή φάση (~4,4 ). Έτσι, το σύστημα απαιτεί μεγάλο αριθμό προσπαθειών διακύμανσης για να ανέβει στην κορυφή του ενεργειακού λόφου. Σε όχι πολύ καλά καθαρισμένο νερό, η ισχυρή υπερψύξη αποτρέπεται από την παρουσία ήδη υπαρχόντων κέντρων κρυστάλλωσης, τα οποία μπορεί να είναι σωματίδια ακαθαρσίας, σωματίδια σκόνης, ανομοιομορφίες των τοιχωμάτων του δοχείου κ.λπ. Στη συνέχεια, η κινητική της ανάπτυξης κρυστάλλων εξαρτάται από τις συνθήκες της μεταφοράς θερμότητας κοντά στο όριο μεταξύ των φάσεων, καθώς και στη μορφολογία της τελευταίας σε ατομικό επίπεδο.μοριακό επίπεδο.
Το πολύ υπερψυκτικό νερό έχει δύο χαρακτηριστικές θερμοκρασίες t h = −36°C και t g = −140°C. Το καλά καθαρισμένο και απαερωμένο νερό στην περιοχή θερμοκρασιών 0°С > t > t h μπορεί να παραμείνει σε κατάσταση υπερψυγμένου υγρού για μεγάλο χρονικό διάστημα. Στο t g< t < t h происходит гомогенное зарождение кристалликов льда, и вода не может находиться в переохлажденном состоянии при любой степени очистки. В условиях достаточно быстрого охлаждения при t < tg подвижность молекул воды настолько падает (а вязкость растет), что она образует стеклообразное твердое тело с аморфной структурой, свойственной жидкостям. При этом в области невысоких давлений образуется аморфная фаза низкой плотности, а в области повышенных – аморфная фаза высокой плотности, то есть вода демонстрирует полиаморфизм. При изменениях давления или температуры одна аморфная фаза скачком переходит в другую с неожиданно большим изменением плотности (>20%).
Υπάρχουν διάφορες απόψεις σχετικά με τη φύση του πολυαμορφισμού του νερού. Έτσι, σύμφωνα με το , αυτή η συμπεριφορά του ισχυρά υπερψυκτικού νερού μπορεί να εξηγηθεί εάν δεχθούμε ότι στο δυναμικό προφίλ της αλληλεπίδρασης δύο μορίων H2O υπάρχουν περισσότερα από ένα ελάχιστο,

Ρύζι. 5(Με ). Υποθετικά προφίλ δυναμικού: a – με ένα ελάχιστο ενεργειακό (για παράδειγμα, το δυναμικό Lennard-Jones U(r) = A/r 6 − B/r 12) και b – με δύο ενεργειακά ελάχιστα, τα οποία αντιστοιχούν σε δύο σταθερές διαμορφώσεις ενός σύμπλεγμα δύο αλληλεπιδρώντων μορίων νερού (1 και 2) με διαφορετικές αποστάσεις μεταξύ των υπό όρους κέντρων των μορίων r H και r L. η πρώτη από αυτές αντιστοιχεί σε μια φάση με μεγαλύτερη πυκνότητα, η δεύτερη - με μια χαμηλότερη
και δύο (Εικ. 5). Τότε η άμορφη φάση με υψηλή πυκνότητα θα αντιστοιχεί στη μέση απόσταση rH και η φάση με χαμηλή πυκνότητα – rL. Η μοντελοποίηση υπολογιστή επιβεβαιώνει αυτή την άποψη, αλλά δεν υπάρχουν ακόμη αξιόπιστα πειραματικά στοιχεία για αυτήν την υπόθεση, ούτε υπάρχει μια αυστηρή θεωρία που να επιβεβαιώνει την εγκυρότητα της χρήσης του δυναμικού διπλού φρεατίου για την περιγραφή τέτοιων ασυνήθιστων ιδιοτήτων του υπερψυκτικού νερού.
Η συμπεριφορά του υπερψυγμένου νερού παρουσιάζει μεγάλο ενδιαφέρον για διάφορους λόγους. Συγκεκριμένα, καθορίζει τις κλιματικές συνθήκες, τη δυνατότητα και τον τρόπο πλοήγησης σε μεγάλα γεωγραφικά πλάτη, κάτι που είναι σχετικό για τη χώρα μας. Κατά τη διαδικασία της δυναμικής κρυστάλλωσης στη διεπαφή, συμβαίνουν πολλά ενδιαφέροντα και ακόμη ελάχιστα κατανοητά φαινόμενα, για παράδειγμα, ανακατανομή ακαθαρσιών, διαχωρισμός και επακόλουθη χαλάρωση ηλεκτρικών φορτίων, συνοδευόμενη από ηλεκτρομαγνητική ακτινοβολία σε ευρεία ζώνη συχνοτήτων κ.λπ. Τέλος, κρυστάλλωση σε ένα εξαιρετικά υπερψυκτικό υγρό είναι εξαιρετικό, εύκολα αναπαραγόμενο πολλές φορές μια κατάσταση μοντέλου της συμπεριφοράς ενός συστήματος που απέχει πολύ από τη θερμοδυναμική ισορροπία και είναι ικανό, ως αποτέλεσμα της ανάπτυξης αστάθειας, να σχηματίσει δενδρίτες διαφόρων τάξεων και διαστάσεων ( τυπικοί εκπρόσωποι είναι νιφάδες χιονιού και σχέδια πάγου στα παράθυρα), βολικά για τη δημιουργία και τη μοντελοποίηση της συμπεριφοράς των φράκταλ.
Εκ πρώτης όψεως, οι διαδικασίες τήξης πάγου φαίνονται πιο εύκολο να αναλυθούν από τις διαδικασίες κρυστάλλωσης. Ωστόσο, αφήνουν και πολλά ερωτηματικά. Για παράδειγμα, πιστεύεται ευρέως ότι το λιωμένο νερό για κάποιο χρονικό διάστημα έχει ιδιότητες διαφορετικές από τις ιδιότητες του συνηθισμένου νερού, τουλάχιστον σε σχέση με βιολογικά αντικείμενα: φυτά, ζώα, ανθρώπους. Πιθανώς, αυτά τα χαρακτηριστικά μπορεί να οφείλονται σε υψηλή χημική καθαρότητα (λόγω του σημειωθέντος χαμηλού συντελεστή δέσμευσης ακαθαρσιών κατά την κρυστάλλωση πάγου), διαφορές στην περιεκτικότητα σε διαλυμένα αέρια και ιόντα, καθώς και στην αποθήκευση της δομής του πάγου σε πολυμοριακά σμήνη του υγρού φάση. Ωστόσο, ο συγγραφέας δεν έχει αξιόπιστες πληροφορίες σχετικά με αυτό που λαμβάνονται με σύγχρονες φυσικές μεθόδους.
Δεν είναι λιγότερο δύσκολη η ανάλυση των μηχανισμών επιρροής των εξωτερικών φυσικών πεδίων, ιδιαίτερα των μαγνητικών πεδίων, στις διεργασίες και τις ιδιότητες του νερού, του πάγου και των μεταπτώσεων φάσης. Ολόκληρη η ζωή μας λαμβάνει χώρα υπό συνθήκες συνεχούς δράσης του μαγνητικού πεδίου της Γης και των ασθενών διακυμάνσεων του. Η μαγνητοβιολογία και οι μέθοδοι μαγνητικής θεραπείας στην ιατρική έχουν αναπτυχθεί εδώ και πολλούς αιώνες. Τέλος, οι μονάδες παράγονται μαζικά και χρησιμοποιούνται ευρέως για τη μαγνήτιση του νερού που χρησιμοποιείται για άρδευση στη γεωργία (προκειμένου να αυξηθεί η παραγωγικότητα), για την τροφοδοσία ατμολεβήτων (για τη μείωση του ρυθμού σχηματισμού αλάτων σε αυτούς) κ.λπ. Ωστόσο, δεν υπάρχει ακόμη ικανοποιητική φυσική περιγραφή των μηχανισμών δράσης του μαγνητικού πεδίου σε αυτές και άλλες παρόμοιες περιπτώσεις.
συμπέρασμα
Το νερό, ο πάγος και οι αμοιβαίοι μετασχηματισμοί φάσης τους εξακολουθούν να είναι γεμάτοι με πολλά μυστήρια. Η επίλυσή τους δεν είναι μόνο ένα πολύ ενδιαφέρον φυσικό πρόβλημα, αλλά είναι επίσης εξαιρετικά σημαντικό για τη ζωή στη Γη, καθώς σχετίζεται άμεσα με την ανθρώπινη υγεία και ευημερία. Ίσως παρέχουν ένα από τα πιο εντυπωσιακά παραδείγματα του ρόλου της ηλεκτρονικής και μοριακής δομής στο σχηματισμό των φυσικών ιδιοτήτων της απλούστερης και γνωστής χημικής σύνθεσης μιας ουσίας.
Βιβλιογραφία:
1. Bogorodsky V.V., Gavrilo V.P. Πάγος. L.: Gidrometeoizdat, 1980. 384 p.
2. Maeno N. Η επιστήμη του πάγου. Μ.: Μιρ, 1988. 231 σελ.
3. Hobbs P.V. Φυσική Πάγου. Οξφόρδη: Παν. Press, 1974. 864 p.
4. Ζατσεπίνα Γ.Ν. Φυσικές ιδιότητες και δομή του νερού. Μ.: Εκδοτικός Οίκος του Κρατικού Πανεπιστημίου της Μόσχας, 1998. 184 σελ.
5. Mishima O., Stanley E. The Relationship between Liquid, Supercooled and Glassy Water // Nature. 1998. Τομ. 396. σσ. 329–335.
6. Zolotukhin I.V. Φράκταλ στη φυσική στερεάς κατάστασης // Soros Educational Journal. 1998. Αρ. 7. σ. 108–113. Κριτής του άρθρου Β.Α. Ο Στρούκοφ
Yuri Ivanovich Golovin, Διδάκτωρ Φυσικών και Μαθηματικών Επιστημών, Καθηγητής, Επικεφαλής. Τμήμα Θεωρητικής και Πειραματικής Φυσικής, Κρατικό Πανεπιστήμιο Tambov. G.R. Derzhavin, Επίτιμος Επιστήμονας της Ρωσικής Ομοσπονδίας. Τομέας επιστημονικών ενδιαφερόντων είναι η ηλεκτρονική δομή των ελαττωμάτων στα στερεά και οι μακροσκοπικές ιδιότητες που προκαλούνται από αυτά. Συγγραφέας και συν-συγγραφέας περισσότερων από 200 επιστημονικών εργασιών, συμπεριλαμβανομένων μονογραφιών και 40 εφευρέσεων.
Πάγος- ορυκτό με χημικό τύπος H 2 O, αντιπροσωπεύει το νερό σε κρυσταλλική κατάσταση.
Χημική σύνθεση πάγου: Η - 11,2%, Ο - 88,8%. Μερικές φορές περιέχει αέριες και στερεές μηχανικές ακαθαρσίες.
Στη φύση, ο πάγος αντιπροσωπεύεται κυρίως από μία από τις πολλές κρυσταλλικές τροποποιήσεις, σταθερή στο εύρος θερμοκρασίας από 0 έως 80°C, με σημείο τήξης 0°C. Υπάρχουν 10 γνωστές κρυσταλλικές τροποποιήσεις του πάγου και του άμορφου πάγου. Το πιο μελετημένο είναι ο πάγος της 1ης τροποποίησης - η μόνη τροποποίηση που βρέθηκε στη φύση. Ο πάγος βρίσκεται στη φύση με τη μορφή του ίδιου του πάγου (ηπειρωτικός, πλωτός, υπόγειος κ.λπ.), καθώς και με τη μορφή χιονιού, παγετού κ.λπ.
Δείτε επίσης:
ΔΟΜΗ
Η κρυσταλλική δομή του πάγου είναι παρόμοια με τη δομή: κάθε μόριο H 2 0 περιβάλλεται από τα τέσσερα μόρια που βρίσκονται πιο κοντά του, βρίσκονται σε ίσες αποστάσεις από αυτόν, ίσες με 2,76Α και βρίσκονται στις κορυφές ενός κανονικού τετραέδρου. Λόγω του χαμηλού αριθμού συντονισμού, η δομή του πάγου είναι διάτρητη, γεγονός που επηρεάζει την πυκνότητά της (0,917). Ο πάγος έχει ένα εξαγωνικό χωρικό πλέγμα και σχηματίζεται από το πάγωμα του νερού στους 0°C και την ατμοσφαιρική πίεση. Το πλέγμα όλων των κρυσταλλικών τροποποιήσεων του πάγου έχει τετραεδρική δομή. Παράμετροι κυψέλης μονάδας πάγου (στους t 0°C): a=0,45446 nm, c=0,73670 nm (το c είναι διπλάσια από την απόσταση μεταξύ γειτονικών κύριων επιπέδων). Όταν πέφτει η θερμοκρασία, αλλάζουν ελάχιστα. Τα μόρια H 2 0 στο πλέγμα πάγου συνδέονται μεταξύ τους με δεσμούς υδρογόνου. Η κινητικότητα των ατόμων υδρογόνου στο πλέγμα πάγου είναι πολύ μεγαλύτερη από την κινητικότητα των ατόμων οξυγόνου, λόγω της οποίας τα μόρια αλλάζουν τους γείτονές τους. Παρουσία σημαντικών δονήσεων και περιστροφικών κινήσεων μορίων στο πλέγμα πάγου, συμβαίνουν μεταφορικά άλματα μορίων από τη θέση της χωρικής τους σύνδεσης, διαταράσσοντας περαιτέρω την τάξη και σχηματίζοντας εξαρθρώσεις. Αυτό εξηγεί την εκδήλωση συγκεκριμένων ρεολογικών ιδιοτήτων στον πάγο, που χαρακτηρίζουν τη σχέση μεταξύ μη αναστρέψιμων παραμορφώσεων (ροής) του πάγου και των τάσεων που τις προκάλεσαν (πλαστικότητα, ιξώδες, αντοχή διαρροής, ερπυσμός κ.λπ.). Λόγω αυτών των συνθηκών, οι παγετώνες ρέουν παρόμοια με τα πολύ παχύρρευστα υγρά, και έτσι ο φυσικός πάγος συμμετέχει ενεργά στον κύκλο του νερού στη Γη. Οι κρύσταλλοι πάγου είναι σχετικά μεγάλοι σε μέγεθος (εγκάρσιο μέγεθος από κλάσματα του χιλιοστού έως αρκετές δεκάδες εκατοστά). Χαρακτηρίζονται από ανισοτροπία του συντελεστή ιξώδους, η τιμή του οποίου μπορεί να ποικίλλει κατά πολλές τάξεις μεγέθους. Οι κρύσταλλοι είναι ικανοί να επαναπροσανατολιστούν υπό την επίδραση φορτίων, γεγονός που επηρεάζει τη μεταμόρφωσή τους και τον ρυθμό ροής των παγετώνων.
ΙΔΙΟΤΗΤΕΣ

Ο πάγος είναι άχρωμος. Σε μεγάλες συστάδες παίρνει μια γαλαζωπή απόχρωση. Γυαλάδα γυαλιού. Διαφανής. Δεν έχει διάσπαση. Σκληρότητα 1,5. Εύθραυστο. Οπτικά θετικός, δείκτης διάθλασης πολύ χαμηλός (n = 1,310, nm = 1,309). Υπάρχουν 14 γνωστές τροποποιήσεις του πάγου στη φύση. Είναι αλήθεια ότι όλα εκτός από τον γνωστό πάγο, ο οποίος κρυσταλλώνεται στο εξαγωνικό σύστημα και χαρακτηρίζεται ως πάγος Ι, σχηματίζεται κάτω από εξωτικές συνθήκες - σε πολύ χαμηλές θερμοκρασίες (περίπου -110150 0C) και υψηλές πιέσεις, όταν οι γωνίες των δεσμών υδρογόνου στο νερό αλλαγή μορίου και σχηματίζονται συστήματα, διαφορετικά από τα εξαγωνικά. Τέτοιες συνθήκες μοιάζουν με αυτές στο διάστημα και δεν συμβαίνουν στη Γη. Για παράδειγμα, σε θερμοκρασίες κάτω των –110 °C, οι υδρατμοί κατακρημνίζονται σε μια μεταλλική πλάκα με τη μορφή οκτάεδρων και σχηματίζουν κύβους σε μέγεθος αρκετών νανόμετρων - αυτός είναι ο λεγόμενος κυβικός πάγος. Εάν η θερμοκρασία είναι ελαφρώς πάνω από -110 °C και η συγκέντρωση ατμών είναι πολύ χαμηλή, σχηματίζεται ένα στρώμα εξαιρετικά πυκνού άμορφου πάγου στην πλάκα.
ΜΟΡΦΟΛΟΓΙΑ

Ο πάγος είναι ένα πολύ κοινό ορυκτό στη φύση. Υπάρχουν διάφοροι τύποι πάγου στον φλοιό της γης: ποτάμι, λίμνη, θάλασσα, έδαφος, έλατο και παγετώνας. Συχνότερα σχηματίζει συσσωματώματα λεπτών κρυσταλλικών κόκκων. Είναι επίσης γνωστοί κρυσταλλικοί σχηματισμοί πάγου που προκύπτουν με εξάχνωση, δηλαδή απευθείας από την κατάσταση ατμού. Σε αυτές τις περιπτώσεις, ο πάγος εμφανίζεται ως σκελετικοί κρύσταλλοι (νιφάδες χιονιού) και συσσωματώματα σκελετικής και δενδριτικής ανάπτυξης (πάγος σπηλαίων, παγετός, παγετός και σχέδια στο γυαλί). Βρίσκονται μεγάλοι καλά κομμένοι κρύσταλλοι, αλλά πολύ σπάνια. Ο N. N. Stulov περιέγραψε κρυστάλλους πάγου στο βορειοανατολικό τμήμα της Ρωσίας, που βρέθηκαν σε βάθος 55-60 m από την επιφάνεια, με ισομετρική και κολονοειδή εμφάνιση και το μήκος του μεγαλύτερου κρυστάλλου ήταν 60 cm και η διάμετρος της βάσης του ήταν 15 εκ. Από απλές μορφές σε κρυστάλλους πάγου, εντοπίστηκαν μόνο οι όψεις του εξαγωνικού πρίσματος (1120), της εξαγωνικής διπυραμίδας (1121) και του πινακοειδούς (0001).
Οι σταλακτίτες πάγου, που στην καθομιλουμένη ονομάζονται «παγάκια», είναι γνωστοί σε όλους. Με διαφορές θερμοκρασίας περίπου 0° στις εποχές του φθινοπώρου-χειμώνα, αναπτύσσονται παντού στην επιφάνεια της Γης με την αργή κατάψυξη (κρυστάλλωση) του νερού που ρέει και στάζει. Είναι επίσης κοινά σε σπηλιές πάγου.
Οι όχθες πάγου είναι λωρίδες παγοκάλυψης από πάγο που κρυσταλλώνεται στα όρια νερού-αέρα κατά μήκος των άκρων των δεξαμενών και συνορεύει με τις άκρες των λακκούβων, τις όχθες ποταμών, λιμνών, λιμνών, δεξαμενών κ.λπ. με τον υπόλοιπο υδάτινο χώρο να μην παγώνει. Όταν μεγαλώσουν πλήρως μαζί, σχηματίζεται ένα συνεχές κάλυμμα πάγου στην επιφάνεια της δεξαμενής.
Ο πάγος σχηματίζει επίσης παράλληλα κιονοειδή συσσωματώματα με τη μορφή ινωδών φλεβών σε πορώδη εδάφη και ανθολίτες πάγου στην επιφάνειά τους.
ΠΡΟΕΛΕΥΣΗ

Ο πάγος σχηματίζεται κυρίως σε λεκάνες νερού όταν πέφτει η θερμοκρασία του αέρα. Ταυτόχρονα, ένας χυλός πάγου που αποτελείται από βελόνες πάγου εμφανίζεται στην επιφάνεια του νερού. Από κάτω, πάνω του αναπτύσσονται μακροί κρύσταλλοι πάγου, των οποίων οι άξονες συμμετρίας έκτης τάξης βρίσκονται κάθετα στην επιφάνεια του φλοιού. Οι σχέσεις μεταξύ των κρυστάλλων πάγου κάτω από διαφορετικές συνθήκες σχηματισμού φαίνονται στο Σχ. Ο πάγος είναι κοινός όπου υπάρχει υγρασία και όπου η θερμοκρασία πέφτει κάτω από τους 0° C. Σε ορισμένες περιοχές, ο πάγος του εδάφους ξεπαγώνει μόνο σε μικρό βάθος, κάτω από το οποίο αρχίζει ο μόνιμος πάγος. Αυτές είναι οι λεγόμενες περιοχές μόνιμου παγετού. Σε περιοχές κατανομής του μόνιμου παγετού στα ανώτερα στρώματα του φλοιού της γης, εντοπίζεται ο λεγόμενος υπόγειος πάγος, μεταξύ των οποίων διακρίνεται ο σύγχρονος και ο απολιθωμένος υπόγειος πάγος. Τουλάχιστον το 10% της συνολικής έκτασης της γης καλύπτεται από παγετώνες· ο μονολιθικός παγωμένος βράχος που τους συνθέτει ονομάζεται παγετώδης πάγος. Ο παγετώδης πάγος σχηματίζεται κυρίως από τη συσσώρευση χιονιού ως αποτέλεσμα της συμπίεσης και του μετασχηματισμού του. Το στρώμα πάγου καλύπτει περίπου το 75% της Γροιλανδίας και σχεδόν όλη την Ανταρκτική. το μεγαλύτερο πάχος των παγετώνων (4330 m) βρίσκεται κοντά στον σταθμό Byrd (Ανταρκτική). Στην κεντρική Γροιλανδία το πάχος του πάγου φτάνει τα 3200 m.
Τα κοιτάσματα πάγου είναι γνωστά. Σε περιοχές με κρύους, μεγάλους χειμώνες και σύντομα καλοκαίρια, καθώς και σε ψηλές ορεινές περιοχές, σχηματίζονται σπηλιές πάγου με σταλακτίτες και σταλαγμίτες, μεταξύ των οποίων τα πιο ενδιαφέροντα είναι η Kungurskaya στην περιοχή Perm των Ουραλίων, καθώς και η σπηλιά Dobshine στο Σλοβακία.
Όταν το θαλασσινό νερό παγώνει, σχηματίζεται θαλάσσιος πάγος. Οι χαρακτηριστικές ιδιότητες του θαλάσσιου πάγου είναι η αλατότητα και το πορώδες, που καθορίζουν το εύρος της πυκνότητάς του από 0,85 έως 0,94 g/cm 3 . Εξαιτίας της τόσο χαμηλής πυκνότητας, οι πάγοι υψώνονται πάνω από την επιφάνεια του νερού κατά 1/7-1/10 του πάχους τους. Ο θαλάσσιος πάγος αρχίζει να λιώνει σε θερμοκρασίες πάνω από -2,3°C. είναι πιο ελαστικό και πιο δύσκολο να σπάσει σε κομμάτια από τον πάγο του γλυκού νερού.
ΕΦΑΡΜΟΓΗ

Στα τέλη της δεκαετίας του 1980, το εργαστήριο Argonne ανέπτυξε μια τεχνολογία για την παραγωγή ιλύος πάγου που μπορεί να ρέει ελεύθερα μέσα από σωλήνες διαφόρων διαμέτρων χωρίς να συλλέγεται σε συσσωρεύσεις πάγου, να κολλάει μεταξύ τους ή να φράζει τα συστήματα ψύξης. Το εναιώρημα αλμυρού νερού αποτελούνταν από πολλούς πολύ μικρούς κρυστάλλους πάγου με στρογγυλό σχήμα. Χάρη σε αυτό, διατηρείται η κινητικότητα του νερού και, ταυτόχρονα, από την άποψη της θερμικής μηχανικής, αντιπροσωπεύει τον πάγο, ο οποίος είναι 5-7 φορές πιο αποτελεσματικός από το απλό κρύο νερό στα συστήματα ψύξης των κτιρίων. Επιπλέον, τέτοια μείγματα είναι πολλά υποσχόμενα για την ιατρική. Πειράματα σε ζώα έδειξαν ότι οι μικροκρύσταλλοι του μείγματος πάγου περνούν τέλεια σε αρκετά μικρά αιμοφόρα αγγεία και δεν καταστρέφουν τα κύτταρα. Το «Icy Blood» παρατείνει το χρόνο κατά τον οποίο μπορεί να σωθεί το θύμα. Ας πούμε, σε περίπτωση καρδιακής ανακοπής, ο χρόνος αυτός επιμηκύνεται, σύμφωνα με συντηρητικές εκτιμήσεις, από 10-15 σε 30-45 λεπτά.
Η χρήση του πάγου ως δομικού υλικού είναι διαδεδομένη στις πολικές περιοχές για την κατασκευή κατοικιών - ιγκλού. Ο πάγος είναι μέρος του υλικού Pikerit που πρότεινε ο D. Pike, από το οποίο προτάθηκε να κατασκευαστεί το μεγαλύτερο αεροπλανοφόρο στον κόσμο.
Πάγος - H 2 O
ΤΑΞΙΝΟΜΗΣΗ
| Strunz (8η έκδοση) | 4/Α.01-10 |
| Nickel-Strunz (10η έκδοση) | 4.ΑΑ.05 |
| Dana (8η έκδοση) | 4.1.2.1 |
| Hey's CIM Ref. | 7.1.1 |