물의 구조. 물의 특성 분자 수준에서 얼음과 물의 주요 차이점
현재 알려진 자연 상태의 고체 물 14가지 중에서 우리는 단 하나만 발견합니다. 바로 얼음입니다. 나머지는 극한의 조건에서 형성되어 특수 실험실 외부에서는 관찰이 불가능합니다. 얼음의 가장 흥미로운 특성은 놀랍도록 다양한 외부 표현입니다. 동일한 결정 구조를 사용하더라도 투명한 우박과 고드름, 푹신한 눈 조각, 눈밭에 촘촘하고 반짝이는 전나무 껍질 또는 거대한 빙하 덩어리의 형태를 취하여 완전히 다르게 보일 수 있습니다.
혼슈 섬 서해안에 위치한 일본의 작은 도시 가가에는 특이한 박물관이 있습니다. 눈과 얼음. 하늘에서 떨어지는 눈송이처럼 아름다운 인공눈송이를 실험실에서 처음으로 키우는 방법을 최초로 배운 나카야 우키히로(Nakaya Ukihiro)가 설립한 회사입니다. 이 박물관에서 방문객들은 일반 얼음 결정의 특징인 바로 이 "육각형" 대칭이기 때문에 방문객들은 사방이 정육각형으로 둘러싸여 있습니다(그런데 그리스어 단어 kristallos는 실제로 "얼음"을 의미합니다). 그것은 많은 고유한 특성을 결정하고 무한한 다양성을 지닌 눈송이가 6개의 광선(흔히 3개 또는 12개 광선이 있는 경우는 드물지만 4개 또는 5개가 있는 경우는 적음)이 있는 별 모양으로 자라도록 만듭니다.
투각의 분자
고체 물 구조의 핵심은 분자 구조에 있습니다. H2O는 사면체(밑면이 삼각형인 피라미드)로 간단하게 표현될 수 있습니다. 중앙에는 산소가 있고 두 꼭지점에는 수소, 더 정확하게는 양성자가 있으며 그 전자는 산소와의 공유 결합 형성에 관여합니다. 나머지 두 꼭지점은 분자 내 결합 형성에 참여하지 않는 산소 원자가 전자 쌍으로 채워져 있으므로 단독이라고 불립니다.
한 분자의 양성자가 다른 분자의 고립된 산소 전자 쌍과 상호작용할 때, 수소 결합이 형성되는데, 이는 분자 내 결합보다 강도는 약하지만 이웃 분자를 함께 묶을 수 있을 만큼 강력합니다. 각 분자는 엄격하게 정의된 각도로 다른 분자와 동시에 4개의 수소 결합을 형성할 수 있으므로 동결 시 조밀한 구조가 생성되지 않습니다. 이 보이지 않는 수소 결합 구조는 속이 빈 채널이 있는 레이스 네트워크로 분자를 배열합니다. 얼음이 가열되자마자 끈이 무너집니다. 물 분자가 메쉬의 빈 공간으로 떨어지기 시작하여 액체의 밀도가 더 높은 구조로 이어지며, 이것이 바로 물이 얼음보다 무겁게 되는 이유입니다.대기압에서 형성되고 0°C에서 녹는 얼음은 가장 일반적이지만 아직 완전히 이해되지 않은 물질입니다. 구조와 속성이 많이 이상해 보입니다. 얼음 결정 격자 부위에는 산소 원자가 규칙적으로 배열되어 정육각형을 형성하지만, 수소 원자는 결합을 따라 다양한 위치를 차지합니다. 원자의 이러한 행동은 일반적으로 비정형입니다. 일반적으로 고체 물질에서는 모든 사람이 동일한 법칙을 따릅니다. 모든 원자가 질서있게 배열된 다음 결정이거나 무작위로 배열되어 무정형 물질입니다.
얼음은 아무리 이상하게 들리더라도 녹기 어렵습니다. 물 분자를 서로 묶는 수소 결합이 없다면 물 분자는 90°C에서 녹을 것입니다. 동시에 물이 얼면 대부분의 알려진 물질에서와 같이 부피가 감소하지 않지만 개방형 얼음 구조가 형성되어 증가합니다.얼음의 "이상함"에는 결정 성장에 의한 전자기 복사 생성도 포함됩니다. 물에 용해된 대부분의 불순물은 얼음이 자라기 시작할 때 얼음으로 옮겨지지 않는다는 것, 즉 얼어붙는다는 것이 오랫동안 알려져 왔습니다. 따라서 가장 더러운 웅덩이에서도 얼음막이 깨끗하고 투명합니다. 불순물은 고체와 액체 매체 사이의 경계면에 서로 다른 부호의 두 층의 전하 형태로 축적되어 상당한 전위차를 유발합니다. 대전된 불순물층은 어린 얼음의 하부 경계를 따라 이동하며 전자기파를 방출합니다. 덕분에 결정화 과정을 자세히 관찰할 수 있다. 따라서 바늘 형태로 길이가 성장하는 결정은 측면 돌기로 덮인 결정과 다르게 방출하며, 성장하는 입자의 방사선은 결정이 깨질 때 발생하는 것과 다릅니다. 방사선 펄스의 모양, 순서, 주파수 및 진폭에 따라 얼음이 얼는 속도와 어떤 종류의 얼음 구조가 얻어지는지 확인할 수 있습니다.
잘못된 얼음
최신 데이터에 따르면 고체 상태의 물에는 14가지 구조적 변형이 있습니다. 그들 중 일부는 결정질이고(대부분) 일부는 비정질이지만 물 분자의 상대적 배열과 특성이 서로 다릅니다. 사실, 우리에게 익숙한 얼음을 제외한 모든 것은 매우 낮은 온도와 높은 압력에서 물 분자의 수소 결합 각도가 변하고 육각형 이외의 시스템이 형성되는 이국적인 조건에서 형성됩니다. 예를 들어, 110°C 미만의 온도에서 수증기는 팔면체 형태로 금속판에 침전되고 크기는 수 나노미터입니다. 이것이 소위 입방체 얼음입니다. 온도가 110°보다 약간 높고 증기 농도가 매우 낮으면 매우 조밀한 무정형 얼음 층이 판에 형성됩니다.
얼음 XIII과 XIV의 마지막 두 변형은 아주 최근인 2006년에 옥스퍼드의 과학자들에 의해 발견되었습니다. 단사정형 격자와 마름모형 격자를 가진 얼음 결정이 존재해야 한다는 40년의 예측은 확인하기 어려웠습니다. 160°C 온도에서 물의 점도가 매우 높고 초순수 과냉각수의 분자가 그러한 양으로 모입니다. 결정핵을 형성하는 것은 어렵다. 촉매는 저온에서 물 분자의 이동성을 증가시키는 염산을 도왔습니다. 이러한 얼음 변형은 지상 자연에서는 형성될 수 없지만 다른 행성의 얼어붙은 위성에서는 찾을 수 있습니다.
위원회는 그렇게 결정했다눈송이는 육각형 결정을 테마로 한 변형인 얼음 단결정이지만 비평형 조건에서 빠르게 성장합니다. 가장 호기심이 많은 사람들은 수세기 동안 자신의 아름다움과 끝없는 다양성의 비밀을 찾기 위해 고군분투해 왔습니다. 천문학자 요하네스 케플러(Johannes Kepler)는 1611년에 "육각형 눈송이에 관하여"라는 논문 전체를 썼습니다. 1665년에 로버트 훅(Robert Hooke)은 현미경으로 본 모든 것을 스케치한 방대한 양의 다양한 모양의 눈송이 그림을 많이 출판했습니다. 현미경으로 찍은 최초의 성공적인 눈송이 사진은 1885년 미국 농부 Wilson Bentley가 촬영했습니다. 그때부터 그는 멈출 수 없었다. 인생이 끝날 때까지 40년 이상 동안 Bentley는 사진을 찍었습니다. 5천 개가 넘는 크리스탈, 단 하나도 똑같은 크리스탈이 없습니다.
Bentley의 가장 유명한 추종자들은 이미 언급된 Ukihiro Nakaya와 미국 물리학자 Kenneth Libbrecht입니다. Nakaya는 눈송이의 크기와 모양이 기온과 수분 함량에 따라 달라진다는 것을 처음으로 제안했으며, 실험실에서 다양한 모양의 얼음 결정을 성장시켜 이 가설을 실험적으로 훌륭하게 확인했습니다. 그리고 Libbrecht는 미리 정해진 모양의 맞춤형 눈송이를 키우기 시작했습니다.
눈송이의 수명은 온도가 떨어지면서 수증기 구름 속에 결정질 얼음 핵이 형성되면서 시작됩니다. 결정화의 중심은 먼지 입자, 고체 입자 또는 이온일 수 있지만 어떤 경우에도 크기가 1/10mm 미만인 얼음 조각은 이미 육각형 결정 격자를 가지고 있습니다.
이 핵의 표면에 응축된 수증기는 먼저 작은 육각형 프리즘을 형성하며, 그 여섯 모서리에서 완전히 동일한 얼음 바늘과 측면 돌기가 자라기 시작합니다. 단순히 배아 주변의 온도와 습도도 동일하기 때문에 똑같습니다. 그 위에는 나무처럼 측면 싹과 가지가 자랍니다. 이러한 결정을 수상돌기, 즉 나무와 유사하다고 합니다.
구름 속에서 위아래로 움직이면서 눈송이는 온도와 수증기 농도가 다른 조건을 만나게 됩니다. 그 모양은 끝까지 육각형 대칭의 법칙을 따르며 변합니다. 이것이 눈송이가 달라지는 방식입니다. 이론적으로는 동일한 고도의 동일한 구름에서 동일하게 "나타날" 수 있습니다. 그러나 각각은 땅에 도달하는 경로가 상당히 길며 평균적으로 눈송이는 시속 0.9km의 속도로 내립니다. 이는 각각 고유한 역사와 최종 형태가 있음을 의미합니다. 눈송이를 이루는 얼음은 투명하지만 그 수가 많을 때 햇빛이 수많은 면에 반사되어 흩어지면 우리에게 흰색의 불투명한 덩어리 같은 인상을 줍니다. 우리는 그것을 눈이라고 부릅니다.
다양한 눈송이와의 혼동을 피하기 위해 국제 눈과 얼음 위원회는 1951년에 판형, 별 결정체, 기둥 또는 기둥, 바늘형, 공간 수상돌기, 끝이 뾰족한 기둥 및 불규칙한 모양 등 매우 간단한 얼음 결정 분류를 채택했습니다. 그리고 세 가지 유형의 얼음 강수량: 고운 눈 알갱이, 얼음 알갱이, 우박.유리의 서리, 흰 서리 및 패턴의 성장에는 동일한 법칙이 적용됩니다. 눈송이와 같은 이러한 현상은 땅, 풀, 나무에서 분자 단위로 응축되어 형성됩니다. 추운 날씨에 따뜻한 실내 공기의 습기가 유리 표면에 응축되면 창문의 패턴이 나타납니다. 그러나 우박은 물방울이 얼거나 수증기로 포화된 구름 속의 얼음이 눈송이의 배아 위에 촘촘한 층으로 얼어붙을 때 형성됩니다. 이미 형성된 다른 눈송이는 우박에 얼어 붙어 우박이 가장 기괴한 모양을 취할 수 있습니다.
지구상의 우리에게는 물의 견고한 변형, 즉 일반적인 얼음만으로도 충분합니다. 말 그대로 인간이 거주하거나 머무르는 모든 영역에 스며 듭니다. 엄청난 양이 모여서 눈과 얼음은 개별 결정이나 눈송이의 특성과 근본적으로 다른 특성을 가진 특별한 구조를 형성합니다. 산악 빙하, 수역의 얼음 덮개, 영구 동토층 및 단순한 계절 적설 덮개는 넓은 지역과 지구 전체의 기후에 큰 영향을 미칩니다. 눈을 본 적이 없는 사람들조차도 지구의 극에 축적된 덩어리의 숨결을 느낍니다. 예를 들어, 세계 해양 수위의 장기적인 변동 형태입니다. 그리고 얼음은 우리 행성의 출현과 생물의 편안한 서식지에 매우 중요하므로 과학자들은 얼음을 위해 특별한 환경, 즉 그 영역을 대기권과 지각 깊숙한 곳으로 확장하는 빙권을 할당했습니다.
Olga Maksimenko, 화학 과학 후보자
맞춤 검색
물 구조
박사. O.V. 모신
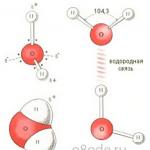
물 분자는 극에 양전하와 음전하를 포함하는 작은 쌍극자입니다. 산소핵의 질량과 전하가 수소핵의 질량과 전하보다 크기 때문에 전자구름은 산소핵 쪽으로 끌어당겨집니다. 이 경우 수소핵이 노출됩니다. 따라서 전자구름은 밀도가 불균일합니다. 수소 핵 근처에는 전자 밀도가 부족하고, 분자 반대편인 산소 핵 근처에는 전자 밀도가 과잉입니다. 물 분자의 극성을 결정하는 것은 바로 이 구조입니다. 양전하와 음전하의 진원지를 직선으로 연결하면 정사면체라는 3차원 기하학적 도형을 얻게 됩니다.
 물 분자의 구조(오른쪽 그림)
물 분자의 구조(오른쪽 그림)
수소 결합이 있기 때문에 각 물 분자는 4개의 이웃 분자와 수소 결합을 형성하여 얼음 분자에 개방형 메쉬 프레임을 형성합니다. 그러나 액체 상태에서 물은 무질서한 액체입니다. 이러한 수소 결합은 자연스럽고 수명이 짧으며 빠르게 끊어지고 다시 형성됩니다. 이 모든 것이 물 구조의 이질성을 초래합니다.
 물 분자 사이의 수소 결합 (아래 왼쪽 그림)
물 분자 사이의 수소 결합 (아래 왼쪽 그림)
물의 구성이 이질적이라는 사실은 오래 전에 확립되었습니다. 얼음이 물 표면에 떠 있다는 것은 오랫동안 알려져 왔습니다. 즉, 결정질 얼음의 밀도는 액체의 밀도보다 작습니다.
거의 모든 다른 물질의 경우 결정은 액상보다 밀도가 높습니다. 또한, 녹은 후에도 온도가 상승함에 따라 물의 밀도는 계속 증가하여 4C에서 최대에 도달합니다. 덜 알려진 것은 물 압축성의 이상입니다. 녹는점에서 40C까지 가열하면 감소하다가 증가합니다. 물의 열용량은 온도에 따라 비단조적으로 달라집니다.
또한 30C 이하의 온도에서는 대기압에서 0.2GPa로 압력이 증가함에 따라 물의 점도가 감소하고 물 분자의 서로에 대한 이동 속도를 결정하는 매개 변수인 자기 확산 계수가 증가합니다.
다른 액체의 경우 관계는 반대이며 일부 중요한 매개변수가 단조롭지 않게 동작하는 경우는 거의 발생하지 않습니다. 처음에는 증가하다가 임계값을 지나면 온도나 압력이 감소합니다. 실제로 물은 단일 액체가 아니라 밀도, 점도 및 구조와 같은 특성이 다른 두 가지 구성 요소의 혼합물이라는 가정이 생겼습니다. 이러한 아이디어는 물 이상 현상에 대한 많은 데이터가 축적된 19세기 말에 나타나기 시작했습니다.
Whiting은 1884년에 물이 두 가지 성분으로 구성되어 있다는 생각을 처음으로 제안했습니다. 그의 저자는 1935년에 출판된 논문 "The Nature of Water. Heavy Water"에서 E.F. Fritsman에 의해 인용되었습니다. 1891년에 V. Rengten은 밀도가 다른 두 가지 물 상태의 개념을 도입했습니다. 그 후, 물이 서로 다른 조성(하이드롤)의 혼합물로 간주되는 많은 작품이 나타났습니다.
1920년대에 얼음의 구조가 밝혀졌을 때 결정 상태의 물 분자는 3차원 연속 네트워크를 형성하고 각 분자는 정사면체의 꼭지점에 4개의 가장 가까운 이웃이 위치한다는 것이 밝혀졌습니다. 1933년에 J. Bernal과 P. Fowler는 유사한 네트워크가 액체 물에도 존재한다고 제안했습니다. 물은 얼음보다 밀도가 높기 때문에 그 안의 분자는 얼음처럼, 즉 광물 삼중암의 실리콘 원자처럼 배열되지 않고 실리카, 석영의 밀도가 더 높은 변형의 실리콘 원자처럼 배열되어 있다고 믿었습니다. 0℃에서 4℃로 가열할 때 물의 밀도가 증가하는 것은 저온에서 트리디마이트 성분의 존재로 설명됩니다. 따라서 Bernal Fowler의 모델은 2구조의 요소를 유지했지만 주요 성과는 연속적인 사면체 네트워크에 대한 아이디어였습니다. 그런 다음 I. Langmuir의 유명한 격언이 나타났습니다. "바다는 하나의 큰 분자입니다." 모델을 과도하게 사양화해도 통일격자 이론을 지지하는 사람의 수가 늘어나지 않았습니다.
1951년이 되어서야 J. Pople은 Bernal Fowler의 모델만큼 구체적이지 않은 연속 격자 모델을 만들었습니다. 포플은 물을 임의의 사면체 네트워크, 즉 구부러지고 길이가 다른 분자 사이의 결합으로 상상했습니다. Pople의 모델은 결합이 구부러지면서 녹는 동안 물이 압축되는 현상을 설명합니다. 얼음 II와 IX의 구조에 대한 첫 번째 정의가 60~70년대에 나타났을 때 결합의 굽힘이 어떻게 구조의 압축으로 이어질 수 있는지가 분명해졌습니다. Pople의 모델은 2상태 모델뿐만 아니라 온도와 압력에 대한 물 특성의 비단조적 의존성을 설명할 수 없습니다. 따라서 두 국가에 대한 아이디어는 오랫동안 많은 과학자들에 의해 공유되었습니다.
그러나 20세기 후반에는 세기 초처럼 가수의 구성과 구조에 대해 상상하는 것이 불가능했습니다. 얼음과 결정질 수화물이 어떻게 작용하는지는 이미 알려져 있었고, 그들은 수소 결합에 대해서도 많이 알고 있었습니다. 연속체 모델(Pople의 모델) 외에도 클러스터와 포접 모델이라는 두 그룹의 혼합 모델이 등장했습니다. 첫 번째 그룹에서 물은 수소 결합으로 연결된 분자 클러스터 형태로 나타났으며, 이는 그러한 결합에 관여하지 않는 분자 바다에 떠있었습니다. 두 번째 그룹의 모델은 물을 공극을 포함하는 수소 결합의 연속적인 네트워크(보통 이 맥락에서 프레임워크라고 함)로 처리했습니다. 그들은 프레임워크의 분자와 결합을 형성하지 않는 분자를 포함합니다. 유명한 이상 현상을 포함하여 물의 모든 특성을 설명하기 위해 클러스터 모델의 두 미세상 특성과 농도 또는 프레임워크 특성과 포접 모델의 공극 채우기 정도를 선택하는 것은 어렵지 않았습니다.
클러스터 모델 중 가장 눈에 띄는 모델은 G. Nemeti와 H. Sheragi의 모델이었습니다.: 그들이 제안한 그림은 결합되지 않은 분자의 바다에 떠 있는 결합된 분자 클러스터를 묘사했으며 많은 논문에 포함되었습니다.
포접 유형의 첫 번째 모델은 1946년 O.Ya Samoilov에 의해 제안되었습니다. 물에서는 육각형 얼음과 유사한 수소 결합 네트워크가 보존되며 그 구멍은 부분적으로 단량체 분자로 채워져 있습니다. 1959년 L. Pauling은 구조의 기초가 일부 결정성 수화물에 내재된 결합 네트워크가 될 수 있음을 제안하는 또 다른 옵션을 만들었습니다.
60년대 후반과 70년대 초에는 이러한 모든 견해의 수렴이 관찰되었다. 두 미세상의 분자가 수소 결합으로 연결된 클러스터 모델의 변형이 나타났습니다. 포접 모델의 지지자들은 공극과 골격 분자 사이의 수소 결합 형성을 인정하기 시작했습니다. 즉, 실제로 이 모델의 저자는 물을 수소 결합의 연속 네트워크로 간주합니다. 그리고 우리는 이 그리드가 얼마나 이질적인지(예: 밀도)에 대해 이야기하고 있습니다. 물이 결합되지 않은 물 분자의 바다에 떠 있는 수소 결합 클러스터라는 생각은 80년대 초반에 G. Stanley가 물의 상전이를 설명하는 삼출 이론을 적용하면서 끝났습니다. 물 모델.
1999년에 러시아의 유명한 물 연구자인 S.V. Zenin은 클러스터 이론에 관한 러시아 과학 아카데미의 의학 및 생물학적 문제 연구소에서 박사 학위 논문을 옹호했습니다. 이는 이 연구 분야의 발전에 중요한 단계였으며 그 복잡성은 다음과 같습니다. 물리학, 화학, 생물학이라는 세 가지 과학의 교차점에 있습니다. 굴절계(S.V. Zenin, B.V. Tyaglov, 1994), 고성능 액체 크로마토그래피(S.V. Zenin et al., 1998) 및 양성자 자기 공명(C S.V. Zenin, 1993)의 세 가지 물리화학적 방법으로 얻은 데이터를 기반으로 기하학적 구조를 구축하고 입증했습니다. 물 분자(구조화된 물)의 주요 안정적인 구조 형성 모델(S.V. Zenin, 2004)은 대조 위상 현미경을 사용하여 이러한 구조의 이미지를 얻었습니다.
 이제 과학은 물의 물리적 특성의 특성과 물 분자 내 인접한 수소와 산소 원자 사이의 수많은 단기 수소 결합이 정보를 감지, 저장 및 전달하는 특별한 관련 구조(클러스터)의 형성에 유리한 기회를 만든다는 것을 입증했습니다. 다양한 정보.
이제 과학은 물의 물리적 특성의 특성과 물 분자 내 인접한 수소와 산소 원자 사이의 수많은 단기 수소 결합이 정보를 감지, 저장 및 전달하는 특별한 관련 구조(클러스터)의 형성에 유리한 기회를 만든다는 것을 입증했습니다. 다양한 정보.
그러한 물의 구조 단위는 장거리 쿨롱 힘에 의해 그 성질이 결정되는 포접물로 구성된 클러스터입니다. 클러스터의 구조는 이러한 물 분자와 발생한 상호 작용에 대한 정보를 암호화합니다. 물 클러스터에서는 산소 원자와 수소 원자 사이의 공유 결합과 수소 결합 사이의 상호 작용으로 인해 릴레이 메커니즘을 통해 양성자(H+)의 이동이 발생하여 클러스터 내 양성자의 비편재화가 발생할 수 있습니다.
다양한 유형의 클러스터로 구성된 물은 막대한 양의 정보를 인식하고 저장할 수 있는 계층적 공간 액정 구조를 형성합니다.
그림(V.L. Voeikov)은 몇 가지 간단한 클러스터 구조의 다이어그램을 예로 보여줍니다.
물 클러스터의 가능한 구조

매우 다른 성격의 물리적 필드는 정보의 전달자가 될 수 있습니다. 따라서 전자기, 음향 및 기타 분야를 사용하여 물의 액정 구조와 다양한 성질의 물체의 원격 정보 상호 작용 가능성이 확립되었습니다. 영향을 미치는 대상은 사람일 수도 있습니다.
물은 초약하고 약한 교번 전자기 방사선의 원천입니다. 가장 혼란스러운 전자기 복사는 구조화된 물에 의해 생성됩니다. 이 경우 해당 전자기장이 유도되어 생물학적 물체의 구조적, 정보적 특성이 변경될 수 있습니다.
최근 몇 년 동안 과냉각수의 특성에 대한 중요한 데이터가 얻어졌습니다. 낮은 온도에서 물을 연구하는 것은 매우 흥미롭습니다. 물은 다른 액체보다 더 많이 과냉각될 수 있기 때문입니다. 일반적으로 물의 결정화는 용기 벽이나 부유하는 고체 불순물 입자의 일부 불균일성에서 시작됩니다. 따라서 과냉각수가 자연적으로 결정화되는 온도를 찾는 것은 쉽지 않습니다. 그러나 과학자들은 이것을 수행했으며 이제 얼음 결정의 형성이 전체 부피에 걸쳐 동시에 발생할 때 소위 균질 핵 생성의 온도는 최대 0.3 GPa의 압력, 즉 존재 영역을 덮는 것으로 알려져 있습니다. 얼음 Ⅱ.
대기압에서 얼음 I과 II를 분리하는 경계까지 이 온도는 231K에서 180K로 떨어졌다가 190K로 약간 증가합니다. 이 임계 온도 이하에서는 원칙적으로 액체 물이 불가능합니다.
얼음 구조(오른쪽 사진)
 그러나 이 온도와 관련된 미스터리가 있습니다. 80년대 중반, 비정질 얼음의 새로운 변형인 고밀도 얼음이 발견되었으며, 이는 물이 두 상태의 혼합물이라는 개념을 되살리는 데 도움이 되었습니다. 결정질 구조가 아니라 밀도가 다른 비정질 얼음 구조가 프로토타입으로 간주되었습니다. 이 개념은 1999년에 E.G. Ponyatovsky와 V.V. Sinitsin에 의해 가장 명확한 형태로 공식화되었으며, 그는 1999년에 다음과 같이 썼습니다. .” 더욱이, 과학자들은 중성자 회절 방법을 사용하여 고압의 과냉각수의 단거리 질서를 연구함으로써 이러한 구조에 해당하는 구성 요소를 찾을 수 있었습니다.
그러나 이 온도와 관련된 미스터리가 있습니다. 80년대 중반, 비정질 얼음의 새로운 변형인 고밀도 얼음이 발견되었으며, 이는 물이 두 상태의 혼합물이라는 개념을 되살리는 데 도움이 되었습니다. 결정질 구조가 아니라 밀도가 다른 비정질 얼음 구조가 프로토타입으로 간주되었습니다. 이 개념은 1999년에 E.G. Ponyatovsky와 V.V. Sinitsin에 의해 가장 명확한 형태로 공식화되었으며, 그는 1999년에 다음과 같이 썼습니다. .” 더욱이, 과학자들은 중성자 회절 방법을 사용하여 고압의 과냉각수의 단거리 질서를 연구함으로써 이러한 구조에 해당하는 구성 요소를 찾을 수 있었습니다.
무정형 얼음의 다형성으로 인해 가상의 저온 임계점보다 낮은 온도에서 물이 두 개의 비혼화성 성분으로 분리된다는 가정이 생겨났습니다. 불행하게도 연구원들에 따르면 0.017GPa 압력에서의 이 온도는 핵 생성 온도보다 230K 낮아서 아직까지 액체 물의 성층화를 관찰할 수 있는 사람은 아무도 없습니다. 따라서 두 상태 모델의 부활은 액체 물에서 수소 결합 네트워크의 이질성에 대한 문제를 제기했습니다. 이러한 이질성은 컴퓨터 모델링을 통해서만 이해할 수 있습니다.
물의 결정 구조에 관해 말하면, 얼음의 14가지 변형이 알려져 있다는 점에 유의해야 합니다.대부분은 자연에서 발견되지 않으며 물 분자는 개성을 유지하고 수소 결합으로 연결되어 있습니다. 반면, 포접 수화물에는 수소 결합 네트워크의 변형이 많이 있습니다. 이러한 네트워크(고압 얼음 및 포접 수화물)의 에너지는 입방체 및 육각형 얼음의 에너지보다 그리 높지 않습니다. 따라서 이러한 구조의 조각은 액체 물에도 나타날 수 있습니다. 무수히 다른 비주기적인 조각을 구성하는 것이 가능하며, 그 분자는 대략 사면체의 꼭지점에 위치한 4개의 가장 가까운 이웃을 가지고 있지만 그 구조는 알려진 얼음 변형의 구조와 일치하지 않습니다. 수많은 계산에서 알 수 있듯이 이러한 조각에 있는 분자의 상호 작용 에너지는 서로 가깝고 액체 물에서 어떤 구조가 우세해야 한다고 말할 이유가 없습니다.
물의 구조적 연구는 다양한 방법을 사용하여 연구될 수 있습니다.양성자 자기공명 분광법, 적외선 분광법, X선 회절 등. 예를 들어 X선과 중성자의 회절은 여러 차례 연구되어 왔습니다. 그러나 이러한 실험은 구조에 대한 자세한 정보를 제공할 수 없습니다. 밀도가 다른 불균일성은 엑스선과 중성자가 작은 각도로 산란되는 것으로 볼 수 있지만 그러한 불균일성은 수백 개의 물 분자로 구성되어 커야 합니다. 빛의 산란을 연구하면 그것들을 볼 수 있을 것이다. 그러나 물은 유난히 투명한 액체이다. 회절 실험의 유일한 결과는 방사형 분포 함수, 즉 산소, 수소 및 산소-수소 원자 사이의 거리입니다. 물 분자의 배열에는 장거리 질서가 없다는 것이 그들로부터 분명해졌습니다. 이러한 기능은 대부분의 다른 액체보다 물에 대해 훨씬 더 빨리 붕괴됩니다. 예를 들어, 실온에 가까운 온도에서 산소 원자 사이의 거리 분포는 2.8, 4.5 및 6.7의 세 가지 최대값만 제공합니다. 첫 번째 최대값은 가장 가까운 이웃까지의 거리에 해당하며 그 값은 대략 수소 결합의 길이와 같습니다. 두 번째 최대값은 사면체 가장자리의 평균 길이에 가깝습니다. 육각형 얼음의 물 분자는 중심 분자 주위에 설명된 사면체의 꼭지점을 따라 위치한다는 것을 기억하십시오. 그리고 매우 약하게 표현되는 세 번째 최대값은 수소 네트워크에서 세 번째 및 더 먼 이웃까지의 거리에 해당합니다. 이 최대값 자체는 그다지 밝지 않으며 추가 피크에 대해 말할 필요가 없습니다. 이러한 분포로부터 더 자세한 정보를 얻으려는 시도가 있었습니다. 그래서 1969년에 I.S. Andrianov와 I.Z. Fisher는 8번째 이웃까지의 거리를 알아냈고, 5번째 이웃에서는 3, 6번째 이웃에서는 3.1로 밝혀졌습니다. 이를 통해 물 분자가 있는 먼 환경에 대한 데이터를 얻을 수 있습니다.
구조를 연구하는 또 다른 방법인 물 결정의 중성자 회절은 X선 회절과 정확히 동일한 방식으로 수행됩니다. 그러나 중성자 산란 길이가 원자마다 크게 다르지 않기 때문에 동형 대체 방법은 허용되지 않습니다. 실제로는 일반적으로 다른 방법을 통해 분자 구조가 대략적으로 결정된 결정을 사용하여 작업합니다. 그런 다음 이 결정에 대해 중성자 회절 강도를 측정합니다. 이러한 결과를 바탕으로 푸리에 변환이 수행되며, 그 동안 측정된 중성자 강도와 위상이 사용되며 비수소 원자를 고려하여 계산됩니다. 구조 모델에서 그 위치가 알려진 산소 원자. 그러면 이렇게 얻은 푸리에 지도에서는 수소와 중수소 원자가 전자밀도 지도에서보다 훨씬 더 큰 가중치로 표현된다. 중성자 산란에 대한 이들 원자의 기여는 매우 큽니다. 예를 들어 이 밀도 맵을 사용하면 수소 원자(음의 밀도)와 중수소(양의 밀도)의 위치를 확인할 수 있습니다.
이 방법의 변형이 가능하며, 이는 물에서 형성된 결정이 측정 전에 중수에 보관된다는 사실로 구성됩니다. 이 경우 중성자 회절을 통해 수소 원자가 어디에 있는지 확인할 수 있을 뿐만 아니라 중수소로 교환될 수 있는 수소 원자도 식별할 수 있습니다. 이는 동위원소(H-D) 교환을 연구할 때 특히 중요합니다. 이러한 정보는 구조가 올바르게 설정되었는지 확인하는 데 도움이 됩니다.
다른 방법을 사용하면 물 분자의 역학을 연구할 수도 있습니다. 이는 준탄성 중성자 산란, 초고속 IR 분광학 및 NMR 또는 표지된 중수소 원자를 사용한 물 확산 연구에 대한 실험입니다. NMR 분광학 방법은 수소 원자의 핵이 일정하고 가변적인 자기장과 상호 작용하는 자기 모멘트(스핀)를 가지고 있다는 사실에 기초합니다. NMR 스펙트럼을 통해 이러한 원자와 핵이 어떤 환경에 위치하는지 판단하여 분자 구조에 대한 정보를 얻을 수 있습니다.
물 결정의 준탄성 중성자 산란에 대한 실험 결과, 가장 중요한 매개변수인 다양한 압력과 온도에서의 자기 확산 계수가 측정되었습니다. 준탄성 중성자 산란으로부터 자기확산계수를 판단하기 위해서는 분자운동의 성질에 대한 가정이 필요하다. 그들이 "점프 대기" 모델이라고도 불리는 Ya.I. Frenkel(러시아의 유명한 이론 물리학자이자 여러 언어로 번역된 고전 책인 "액체 운동 이론"의 저자)의 모델에 따라 움직인다면, 그러면 분자의 정착 수명(점프 사이의 시간)은 3.2피코초입니다. 펨토초 레이저 분광법의 최신 방법을 사용하면 끊어진 수소 결합의 수명을 추정할 수 있습니다. 파트너를 찾는 데는 200fs의 양성자가 필요합니다. 그러나 이는 모두 평균값입니다. 수치 실험이라고도 불리는 컴퓨터 시뮬레이션을 통해서만 물 분자 운동의 구조와 특성을 자세히 연구할 수 있습니다.

이것은 컴퓨터 모델링 결과에 따른 물의 구조입니다 (화학 과학 박사 G.G. Malenkov에 따르면). 일반적인 무질서한 구조는 두 가지 유형의 영역(어두운 공과 밝은 공으로 표시됨)으로 나눌 수 있으며, 예를 들어 보로노이 다면체의 부피(a), 즉각적인 환경의 사면체 정도( b) 위치 에너지 값(c), 그리고 각 분자에 4개의 수소 결합이 있을 때(d). 그러나 이러한 영역은 문자 그대로 몇 피코초 후에 위치가 변경됩니다.
시뮬레이션은 이렇게 진행됩니다. 얼음 구조를 취하여 녹을 때까지 가열합니다. 그런 다음 물이 결정의 기원을 잊을 때까지 잠시 후 순간적으로 현미경 사진을 찍습니다.
물의 구조를 분석하기 위해 세 가지 매개변수가 선택됩니다.
-정사면체의 꼭지점에서 분자의 국지적 환경의 편차 정도;
-분자의 잠재적 에너지;
-소위 보로노이 다면체의 부피.
이 다면체를 구성하려면 주어진 분자에서 가장 가까운 분자까지의 모서리를 가져와서 반으로 나누고 모서리에 수직인 이 점을 통과하는 평면을 그립니다. 이는 분자당 부피를 제공합니다. 다면체의 부피는 밀도이고, 사면체는 수소 결합의 왜곡 정도이며, 에너지는 분자 구성의 안정성 정도입니다. 이러한 각 매개변수의 값이 유사한 분자는 별도의 클러스터로 그룹화되는 경향이 있습니다. 저밀도 영역과 고밀도 영역은 서로 다른 에너지 값을 가지지만 동일한 에너지 값을 가질 수도 있습니다. 실험에 따르면 구조가 다른 영역, 클러스터가 자발적으로 발생하고 자발적으로 분해되는 것으로 나타났습니다. 물의 전체 구조는 살아 있고 끊임없이 변화하며, 이러한 변화가 일어나는 시간은 매우 짧습니다. 연구진은 분자의 움직임을 모니터링한 결과 약 0.5ps의 주파수와 1옹스트롬의 진폭으로 불규칙한 진동을 수행한다는 사실을 발견했습니다. 피코초 동안 지속되는 드물게 느린 옹스트롬 점프도 관찰되었습니다. 일반적으로 30ps에서 분자는 8~10옹스트롬을 이동할 수 있습니다. 지역 환경의 수명도 짧습니다. 보로노이 다면체와 비슷한 부피 값을 갖는 분자로 구성된 영역은 0.5ps 안에 붕괴할 수도 있고, 수 피코초 동안 살 수도 있습니다. 그러나 수소결합 수명의 분포는 매우 크다. 그러나 이번에는 40ps를 넘지 않으며, 평균값은 수ps이다.
결론적으로 강조해야 할 점은 물의 클러스터 구조 이론에는 많은 함정이 있습니다.예를 들어, Zenin은 물의 주요 구조 요소가 4개의 12면체의 융합으로 형성된 57개 분자의 클러스터라고 제안했습니다. 그들은 공통된 면을 가지고 있으며 중심은 정사면체를 형성합니다. 물 분자가 오각형 정십이면체의 꼭지점에 위치할 수 있다는 것은 오랫동안 알려져 왔습니다. 이러한 십이면체는 가스 수화물의 기초입니다. 따라서 특정 구조가 우세하고 오랫동안 존재할 수 없다고 이미 말했지만 물에 그러한 구조가 존재한다고 가정하는 것은 놀라운 일이 아닙니다. 그러므로 이 원소가 주요 원소로 가정되고 정확히 57개의 분자를 포함한다는 것은 이상합니다. 예를 들어 공에서는 서로 인접한 12면체로 구성되고 200개의 분자를 포함하는 동일한 구조를 조립할 수 있습니다. Zenin은 물의 3차원 중합 과정이 57개의 분자에서 멈춘다고 주장합니다. 그의 의견으로는 더 큰 동료가 있어서는 안된다. 그러나 만약 그렇다면, 수소 결합으로 서로 연결된 엄청난 수의 분자를 포함하는 육각형 얼음 결정은 수증기로부터 침전될 수 없습니다. Zenin 클러스터의 성장이 57개 분자에서 멈춘 이유는 전혀 명확하지 않습니다. 모순을 피하기 위해 Zenin은 클러스터를 거의 천 개의 분자로 구성된 더 복잡한 형태인 마름모면체로 압축하며 원래 클러스터는 서로 수소 결합을 형성하지 않습니다. 왜? 표면의 분자는 내부의 분자와 어떻게 다른가요? Zenin에 따르면 능면체 표면의 수산기 패턴은 물에 대한 기억을 제공합니다. 결과적으로 이러한 큰 복합체의 물 분자는 단단히 고정되어 있으며 복합체 자체는 고체입니다. 이러한 물은 흐르지 않으며 분자량과 관련된 녹는점이 매우 높아야 합니다.
Zenin의 모델은 물의 어떤 특성을 설명합니까? 이 모델은 사면체 구조를 기반으로 하기 때문에 X선 및 중성자 회절 데이터와 어느 정도 일치할 수 있습니다. 그러나 모델이 녹는 동안 밀도 감소를 설명할 수 있을 것 같지 않습니다. 정십이면체의 패킹은 얼음보다 밀도가 낮습니다. 그러나 유동성, 자기 확산 계수의 큰 값, 짧은 상관 관계 및 피코초 단위로 측정되는 유전 완화 시간과 같은 동적 특성을 갖는 모델에 동의하는 것이 가장 어렵습니다.
박사. O.V. 모신
참고자료:
G.G. Malenkov. 물리화학의 발전, 2001년
S.V.Zenin, B.M. 폴라뉴어, B.V. Tyaglov. 물 분획의 존재에 대한 실험적 증거. G. 동종요법 의학 및 침술. 1997.No.2.P.42-46.
S.V. 제닌, B.V. Tyaglov. 물 분자 결합 구조의 소수성 모델. J. 물리화학, 1994. T. 68. No. 4. P. 636-641.
S.V. 양성자 자기공명법을 이용한 물의 구조 연구. Dokl.RAN.1993.T.332.No.3.S.328-329.
S.V.Zenin, B.V.Tyaglov. 소수성 상호 작용의 본질. 수용액에서 배향 장의 출현. J. 물리화학, 1994. T. 68. No. 3. P. 500-503.
S.V. 제닌, B.V. Tyaglov, G.B. Sergeev, Z.A. 샤바로바. NMR을 이용한 뉴클레오티다미드의 분자내 상호작용 연구. 제2차 전노조 총회 자료. 동적 입체화학. Odessa.1975.p.53.
S.V. 제닌. 생명체의 행동과 안전을 통제하기 위한 기초로서 물의 구조화된 상태. 명제. 생물학 박사. 주립 과학 센터 "의료 및 생물학적 문제 연구소"(SSC "IMBP"). 보호됨 1999. 05. 27. UDC 577.32:57.089.001.66.207 p.
그리고. Slesarev. 연구 진행 보고서
탐보프 주립대학교의 이름을 따서 명명되었습니다. G.R. 데르자비나
소로스 교육 저널, 6권, 9호, 2000
물과 얼음: 우리는 그것들에 대해 충분히 알고 있나요?
유. I. 골로빈
물과 얼음의 물리적 성질을 설명한다. 이러한 물질의 다양한 현상의 메커니즘이 논의됩니다. 오랜 기간의 연구와 단순한 화학적 구성에도 불구하고 물과 얼음은 지구상의 생명체에게 매우 귀중한 물질이지만 복잡한 동적 양성자와 분자 구조로 인해 많은 신비를 품고 있습니다.물과 얼음의 물리적 특성에 대한 간략한 개요가 제공됩니다. 그 안에 있는 다양한 현상의 메커니즘이 고려됩니다. 수세기에 걸친 연구의 역사, 가장 단순한 화학 구성 및 지구상 생명체에 대한 탁월한 중요성에도 불구하고 물과 얼음의 본질은 복잡한 동적 양성자와 분자 구조로 인해 많은 신비로 가득 차 있음이 밝혀졌습니다.
사람들은 단순함을 더 원하지만,
그럼에도 불구하고 그들에게는 그 콤플렉스가 더 명확합니다.
B.L. 파스닙
아마도 지구상에 액체와 고체 상태의 물보다 더 널리 퍼져 있고 동시에 더 신비한 물질은 없을 것입니다. 실제로 모든 생명체는 물에서 나오며 그 중 50% 이상으로 구성되어 있으며 지구 표면의 71%가 물과 얼음으로 덮여 있으며 북부 지역의 상당 부분이 영구 동토층이라는 사실을 기억하는 것만으로도 충분합니다. 지구상의 얼음 총량을 시각화하기 위해 얼음이 녹으면 세계 해양의 물이 50m 이상 상승하여 전 세계의 거대한 육지 지역이 범람하게 될 것이라는 점에 주목합니다. 태양계를 포함한 우주에서 거대한 얼음 덩어리가 발견되었습니다. 물이 사용되지 않는 다소 중요한 생산이나 인간 활동은 하나도 없습니다. 최근 수십 년 동안 천연 탄화수소의 얼음과 같은 고체 수화물 형태로 대량의 연료 매장량이 발견되었습니다.
동시에, 최근 몇 년간 물의 물리학 및 물리화학 분야에서 수많은 성공을 거둔 이후, 이 단순한 물질의 특성이 완전히 이해 가능하고 예측 가능하다고 주장하기는 어렵습니다. 이 기사에서는 물과 얼음의 가장 중요한 물리적 특성과 주로 저온 상태의 물리학과 관련된 해결되지 않은 문제에 대한 간략한 개요를 제공합니다.
이것은 복잡한 분자이다
물의 물리화학에 대한 현대적 이해의 기초는 약 200년 전 헨리 캐번디시(Henry Cavendish)와 앙투안 라부아지에(Antoine Lavoisier)에 의해 확립되었습니다. 그들은 중세 연금술사가 믿었던 것처럼 물이 단순한 화학 원소가 아니라 산소와 수소의 화합물이라는 것을 발견했습니다. 특정 비율. 사실, 물을 생성하는 수소(수소)는 이 발견 이후에야 그 이름을 얻었고, 물은 이제 모든 학생들에게 알려진 현대 화학 명칭인 H 2 O를 얻었습니다.
따라서 H 2 O 분자는 두 개의 수소 원자와 하나의 산소 원자로 구성됩니다. 물의 광학 스펙트럼 연구에 의해 확립된 바와 같이, 움직임이 전혀 없는(진동 및 회전 없이) 가상 상태에서 수소와 산소 이온은 산소가 차지하는 꼭지점의 각도와 함께 이등변삼각형의 꼭지점 위치를 차지해야 합니다. 104.5°(그림 1, a). 여기되지 않은 상태에서 H + 이온과 O 2− 이온 사이의 거리는 0.96 Å입니다. 이 구조 덕분에 물 분자는 쌍극자입니다. 왜냐하면 O 2− 이온이 위치한 영역의 전자 밀도가 H + 이온 영역보다 훨씬 높으며 가장 간단한 모델 인 구 모델 - 물의 성질을 설명하는 데에는 적합하지 않습니다. 양성자가 위치한 영역에 두 개의 작은 부풀어오름이 있는 공 형태의 물 분자를 상상할 수 있습니다(그림 1, b). 그러나 이것은 물의 또 다른 특징, 즉 분자 사이에 방향성 수소 결합을 형성하는 능력을 이해하는 데 도움이 되지 않습니다. 이는 느슨한 형성에 큰 역할을 하지만 동시에 대부분을 결정하는 매우 안정적인 공간 구조입니다. 액체와 고체 상태 모두의 물리적 특성.
쌀. 1. H 2 O 단량체의 기하학적 다이어그램(a), 평면 모델(b) 및 공간 전자 구조(c) 산소 원자의 외부 껍질에 있는 4개의 전자 중 2개가 수소 원자와 공유 결합을 생성하는 데 관여하며, 다른 두 개는 H-O-H 평면에 수직인 평면인 매우 긴 전자 궤도를 형성합니다.
수소 결합은 수소 원자를 통해 발생하는 한 분자 또는 이웃 분자의 원자 사이의 결합이라는 것을 기억합시다. 공유 결합과 비가 결합 사이의 중간 위치를 차지하며 수소 원자가 두 개의 전기 음성 원자(O, N, F 등) 사이에 위치할 때 형성됩니다. H 원자의 전자는 양성자와 상대적으로 약하게 결합되어 있으므로 최대 전자 밀도는 전기 음성도가 더 높은 원자로 이동하고 양성자는 노출되어 다른 전기 음성도 원자와 상호 작용하기 시작합니다. 이 경우 O⋅⋅⋅O, N⋅⋅⋅O 원자 등이 더 가까워집니다. 수소 원자가 없을 때 그들 사이에 확립되는 거리에 가까운 거리 수소 결합은 물의 구조를 결정할 뿐만 아니라 단백질, 탄수화물, 핵산 등 생체 분자의 생명에 매우 중요한 역할을 합니다. .
분명히 물의 성질을 설명하려면 분자의 전자 구조를 고려해야 합니다. 아시다시피, 산소 원자는 상부 껍질에 4개의 전자를 갖고 있는 반면, 수소 원자는 1개의 전자만 가지고 있습니다. 각 공유 O-H 결합의 형성에는 산소와 수소 원자로부터 전자 하나가 포함됩니다. 산소에 남아 있는 두 개의 전자는 고립된 물 분자에서 H 2 O 분자 내부의 결합 형성에 참여하지 않고 자유롭게 남아 있기 때문에 고립 전자쌍이라고 합니다. 그러나 다른 분자에 접근할 때 이러한 고립 전자는 물의 분자 구조 형성에 결정적인 역할을 합니다.
고독한 전자는 O-H 결합에 의해 반발되므로 그 궤도는 수소 원자의 반대 방향으로 강하게 늘어나고 궤도 평면은 O-H-O 결합에 의해 형성된 평면에 대해 회전합니다. 따라서 3차원 좌표공간에서 물 분자를 묘사하는 것이 더 정확할 것입니다. xyz중앙에 산소 원자가 있고 두 꼭지점에 수소 원자가있는 사면체 형태입니다 (그림 1, c). H 2 O 분자의 전자 구조는 물과 얼음 모두에서 수소 결합의 복잡한 3차원 네트워크로 결합하기 위한 조건을 결정합니다. 각 양성자는 다른 분자의 고독한 전자와 결합을 형성할 수 있습니다. 첫 번째 분자는 수용체 역할을 하고 두 번째 분자는 기증자 역할을 하여 수소 결합을 형성합니다. 각 H2O 분자에는 두 개의 양성자와 두 개의 고립 전자가 있기 때문에 동시에 다른 분자와 네 개의 수소 결합을 형성할 수 있습니다. 따라서 물은 연결의 동적 특성을 지닌 복잡한 관련 액체이며, 분자 수준에서 그 특성에 대한 설명은 다양한 정도의 복잡성과 엄격함을 갖는 양자 역학 모델의 도움을 통해서만 가능합니다.
얼음과 그 성질
보통 사람의 관점에서 볼 때, 얼음은 대기 중에서 우박으로, 지붕 가장자리에서 고드름으로, 수역에서 판으로 형성되더라도 거의 동일합니다. 물리적 관점에서 볼 때, 분자 구조와 메조스코픽 구조가 다른 다양한 종류의 얼음이 있습니다. 상압에 존재하는 얼음에서는 각 H 2 O 분자가 4개의 다른 분자로 둘러싸여 있습니다. 즉 구조의 배위수는 4입니다(소위 얼음 I h). 해당 결정 격자인 육각형은 밀집되어 있지 않으므로 일반 얼음의 밀도(~0.9 g/cm 3)는 물의 밀도(~1 g/cm 3)보다 낮습니다. 그 구조는 다음과 같습니다. X선 회절 연구에 따르면 평균 배위수는 ~4.4입니다(얼음 Ih의 경우 4). 오직 산소 원자만이 얼음 구조에서 고정된 위치를 차지하고 있습니다. 두 개의 수소 원자는 다른 이웃과 H 2 O 분자의 4개 결합에서 서로 다른 위치를 차지할 수 있습니다. 격자의 육각형으로 인해 자유 상태에서 성장하는 결정(예: 눈송이)은 육각형 모양을 갖습니다.
그러나 육각형 상은 얼음의 유일한 존재 형태와는 거리가 멀다. 다른 결정상의 정확한 수(얼음의 다형성 형태)는 아직 알려지지 않았습니다. 이는 고압 및 저온에서 형성됩니다(그림 2). 일부 연구자들은 그러한 상의 12개가 정확하게 확립된 것으로 간주하는 반면 다른 연구자들은 이를 최대 14개까지 계산합니다. 물론 이것이 다형성을 갖는 유일한 물질은 아닙니다(예를 들어 화학적으로 동일한 탄소 원자로 구성된 흑연과 다이아몬드를 기억하십시오) ), 그러나 오늘날까지 계속해서 발견되고 있는 다양한 상 얼음의 수는 놀랍습니다. 위의 모든 것은 얼음 결정 격자의 산소 이온 배열과 관련이 있습니다. 양성자(수소 이온)의 경우 중성자 회절을 통해 알 수 있듯이 배열이 매우 불규칙합니다. 따라서 결정질 얼음은 잘 정돈된 매질(산소와 관련하여)인 동시에 무질서한 매질(수소와 관련하여)입니다.

쌀. 2.결정질 얼음의 상태 다이어그램.
로마 숫자는 존재 영역을 나타냅니다.
안정적인 상의 형성. Ice IV는 준안정성 물질입니다.
for, 영역 V 내부 다이어그램에 위치
얼음은 가단성이 있고 유동적인 것처럼 보입니다. 이는 온도가 융점에 가깝고(즉, 대기압에서 t = 0°C) 하중이 오랫동안 가해지는 경우에 해당됩니다. 그리고 녹는점에 가까운 온도에서 가장 단단한 물질(예: 금속)도 비슷한 방식으로 거동합니다. 얼음 및 기타 많은 결정질 고체의 소성 변형은 결정을 통한 다양한 구조적 결함(공극, 격자간 원자, 결정립 경계 및 가장 중요한 전위)의 핵 생성 및 이동의 결과로 발생합니다. 우리 세기의 30년대에 확립된 바와 같이, 소성 변형에 대한 결정질 고체의 저항의 급격한 감소를 미리 결정하는 것은 후자의 존재입니다(이상적인 격자의 저항에 비해 10 2 –10 4배). 지금까지 얼음 Ih에서는 육각형 구조의 특징적인 모든 유형의 전위가 발견되었으며, 이들의 미세기계적, 전기적 특성이 연구되었습니다.
단결정 얼음의 기계적 특성에 대한 변형율의 영향은 그림 1에 잘 설명되어 있습니다. 3, N. Maeno의 책에서 발췌. 변형률이 증가함에 따라 소성 흐름에 필요한 기계적 응력 σ가 빠르게 증가하고 σ에 대한 상대 변형률 E의 의존성에 따라 거대한 항복 치형이 나타나는 것을 볼 수 있습니다.

쌀. 삼.(에 의해 ). t = −15°С에서 얼음 단결정 Ih에 대한 응력 상대 변형 곡선(압축 축에 대해 45° 각도로 배향된 기저 평면을 따라 미끄러짐). 곡선의 숫자는 상대 변형률( Δl– 샘플 길이의 변화 엘~ 동안 ∆τ
) 10 −7 s −1 단위

쌀. 4.얼음의 양성자 하위 시스템에서 결함 형성 계획: a – 한 쌍의 이온 결함 H 3 O + 및 OH –; b – 방향성 Bjerrum 결함 쌍 D 및 L
얼음의 전기적 특성은 그다지 놀랍지 않습니다. 전도성의 크기와 온도가 증가함에 따라 기하급수적으로 급격한 증가는 얼음과 금속 도체를 뚜렷하게 구별하며 반도체와 동등하게 만듭니다. 얼음은 더러운 물이나 용액에서 자라더라도 일반적으로 화학적으로 매우 순수합니다(더러운 웅덩이에 있는 깨끗하고 투명한 얼음 조각을 생각해 보세요). 이는 얼음 구조의 불순물 용해도가 낮기 때문입니다. 결과적으로, 냉동 중에 불순물은 결정화 전면에서 액체로 밀려나 얼음 구조에 들어 가지 않습니다. 그렇기 때문에 갓 내린 눈은 항상 하얗고, 그 눈에서 나오는 물은 유난히 깨끗합니다.
자연은 현명하게도 지구 대기 전체에 거대한 정수장을 제공했습니다. 따라서 얼음에서는 높은 불순물 전도성(예를 들어 도핑된 실리콘의 경우)을 기대할 수 없습니다. 그러나 금속처럼 자유 전자가 없습니다. 20세기 50년대에만 얼음의 전하 운반체가 무질서한 양성자, 즉 얼음이 양성자 반도체라는 것이 확립되었습니다.
위에서 언급한 양성자 호핑은 얼음 구조에 이온성 결함과 방향성 결함이라는 두 가지 유형의 결함을 생성합니다(그림 4). 첫 번째 경우에는 하나의 H 2 O 분자에서 다른 분자로의 수소 결합을 따라 양성자 점프가 발생하여 (그림 4, a) 한 쌍의 이온 결함 H 3 O + 및 OH-가 형성됩니다. 두 번째 - 한 분자 H 2 O의 인접한 수소 결합 (그림 4, b)으로 인해 L 및 D 결함이라고 불리는 한 쌍의 방향성 Bjerrum 결함이 발생합니다 (독일어에서 비어 있음 및 도펠트 - 이중 ). 공식적으로 이러한 점프는 H 2 O 분자의 120° 회전으로 간주될 수 있습니다.
이온만 이동하거나 방향성 결함만 이동하여 직류의 흐름이 불가능합니다. 예를 들어, H 3 O + 이온이 그리드의 일부를 통과하면 다음 유사한 이온은 동일한 경로를 통과할 수 없습니다. 그러나 이 경로를 따라 D-결함을 통과하게 되면 양성자의 배열이 원래대로 돌아가게 되므로 다음 H 3 O + 이온이 통과할 수 있게 된다. OH-와 L 결함은 비슷하게 행동하므로 화학적으로 순수한 얼음의 전기 전도도는 개수가 적은 이온 결함에 의해 제한됩니다. 반대로, 유전체 분극은 더 많은 방향성 Bjerrum 결함으로 인해 발생합니다. 실제로 외부 전기장이 가해지면 두 과정이 병렬로 일어나 얼음이 직류를 전도함과 동시에 강한 유전분극을 경험하게 되는데, 즉 반도체의 성질과 반도체의 성질을 모두 발휘하게 된다. 절연체. 최근 몇 년 동안 벌크 및 간기 경계 모두에서 저온에서 순수한 얼음의 강유전성 및 압전 특성을 발견하려는 시도가 계속되었습니다. 전위 및 기타 구조적 결함의 존재와 관련된 몇 가지 의사 압전 효과가 발견되었지만 아직 그 존재에 대한 완전한 확신은 없습니다.
얼음의 표면과 결정화의 물리학
반도체 기술의 발전, 소자 기반의 미세화, 평면 기술로의 전환과 관련하여 지난 10년간 표면 물리학에 대한 관심이 크게 높아졌습니다. 고체의 표면 근처 상태를 연구하기 위해 많은 정교한 기술이 개발되었으며, 이는 금속, 반도체 및 유전체 연구에 유용한 것으로 입증되었습니다. 그러나 증기나 액체에 인접한 얼음 표면의 구조와 특성은 여전히 불분명합니다. M. Faraday가 제시한 가장 흥미로운 가설 중 하나는 얼음 표면에 녹는점보다 훨씬 낮은 온도에서도 수십에서 수백 옹스트롬 두께의 준액체 층이 존재한다는 것입니다. 이에 대한 기초는 고도로 극성화된 H 2 O 분자의 표면 근처 층 구조에 대한 추측적 구성 및 이론뿐만 아니라 얼음 표면의 위상 상태에 대한 미묘한 결정(핵 자기 공명 사용) 및 그 표면 전도성과 온도에 대한 의존성. 그러나 실제로 가장 중요한 경우 눈과 얼음의 표면 특성은 준액체층이 아닌 거시적인 물막의 존재에 의해 결정될 가능성이 높습니다.
햇빛, 따뜻한 대기 또는 그 위를 미끄러지는 단단한 물체(스케이트, 스키, 썰매 선수)의 영향으로 얼음 표면층을 녹이는 것은 낮은 마찰 계수를 달성하는 데 중요합니다. 낮은 미끄럼 마찰은 종종 생각되는 것처럼 증가된 압력의 영향으로 용융 온도가 감소한 결과가 아니라 마찰열 방출의 결과입니다. 계산에 따르면 약 1 MPa의 압력이 발생하는 날카롭게 날카로운 스케이트가 얼음 위에서 미끄러지는 경우에도 압력의 영향으로 녹는 온도가 약 0.1°C만 감소하며 이는 마찰량에 큰 영향을 미칩니다.
물과 얼음의 특성을 기술하는 데 있어 확립된 전통은 이 물질을 동족체(H 2 S, H 2 Se, H 2 Te)와 구별하는 많은 변칙적 특성에 대한 설명과 논의입니다. 아마도 가장 중요한 것은 (단순 물질 중에서) 비융해열(결정화)과 열용량이 매우 높다는 것입니다. 즉, 얼음은 녹기 어렵고 물은 얼기 어렵습니다. 결과적으로 우리 행성의 기후는 일반적으로 매우 온화하지만 물이 없는 경우(예: 뜨거운 아프리카의 사막) 낮과 밤의 기온 대비가 바다 해안보다 훨씬 높습니다. 위도. 생물권에 있어서 매우 중요한 것은 결정화 동안 부피가 증가하고 알려진 대부분의 물질처럼 감소하지 않는 특성입니다. 그 결과, 얼음은 가라앉지 않고 물에 떠서 추운 날씨에 수역의 결빙 속도를 크게 늦추어 겨울 동안 그 안에 피난처를 찾는 모든 생물을 보호합니다. 이는 또한 온도가 0°C로 떨어질 때 물 밀도의 비단조적인 변화에 의해 촉진됩니다. 이는 300여 년 전에 발견된 가장 잘 알려진 물의 변칙적 특성 중 하나입니다. 최대 밀도는 t = 4°C에서 달성되며, 이는 4°C 미만의 온도로 냉각된 표면 근처의 물층이 바닥으로 가라앉는 것을 방지합니다. 액체의 대류 혼합이 차단되어 추가 냉각 속도가 크게 느려집니다. 물의 다른 이상 현상은 오랫동안 알려져 왔습니다. 20°C의 전단 점도, 40°C의 비열, 46°C의 등온 압축성, 60°C의 음속입니다. 물의 점도는 압력이 증가함에 따라 감소하며 다른 액체처럼 증가하지 않습니다. 물의 변칙적인 특성은 분자의 구조적 특징과 분자간 상호 작용의 특성으로 인해 발생한다는 것이 분명합니다. 후자에 관한 완전한 명확성은 아직 달성되지 않았습니다. 위에서 설명한 특성은 열역학적 평형 조건 하에 존재하는 물, 얼음 및 이들 사이의 경계면에 적용됩니다. 특히 열역학적 평형 상태와는 거리가 먼 조건에서 물-얼음 상전이의 역학을 설명하려고 할 때 완전히 다른 수준의 복잡성 문제가 발생합니다.
모든 상 전이의 열역학적 원인은 경계면 Δμ = µ 1 −μ 2의 한쪽과 다른 쪽 입자의 화학적 전위 차이입니다. 화학 포텐셜 μ는 시스템 내 입자 수 N이 변할 때 열역학적 포텐셜의 변화를 결정하는 상태 함수입니다. 즉, μ = G/N입니다. 여기서 G = H − TS는 깁스 열역학적 포텐셜, H는 엔탈피, S는 엔트로피, T는 온도입니다. 열역학적 전위의 차이는 거시적 과정의 원동력입니다(도체 끝의 전위 차이가 전류의 원인이 되는 것처럼). µ1 = µ2에서는 두 상이 원하는 만큼 오랫동안 평형 상태로 공존할 수 있습니다. 상압에서 물의 화학 퍼텐셜은 t = 0°C에서 얼음의 화학 퍼텐셜과 같습니다. t에서< 0°С более низким химическим потенциалом обладает лед, но это еще не означает, что при любом, самом маленьком переохлаждении начнется кристаллизация. Опыт показывает, что тщательно очищенный от примесей, обезгаженный, деионизированный расплав может быть переохлажден относительно точки равновесия фаз на десятки кельвин (а для некоторых веществ и на сотни). Анализ показывает, что причина заключается в отсутствии зародышей новой фазы (центров кристаллизации, конденсации, парообразования и т.д.).
배아는 준안정 상태인 환경 자체로부터 균질하게 형성될 수도 있지만 이를 위해서는 특정 조건이 충족되어야 합니다. 결정과 용융물(또는 증기, 용액) 사이의 인터페이스가 추가 에너지 Sα를 도입한다는 사실을 고려하여 상황을 고려해 보겠습니다. 여기서 S는 경계 영역이고 α는 표면 에너지입니다. 또한, 종결정을 형성한 N 분자는 액체보다 NΔμ만큼 낮은 에너지를 갖습니다. 결과적으로 핵이 나타날 때 시스템의 총 에너지 변화 ΔU = −NΔμ + Sα는 N에 비단조적으로 의존하는 것으로 나타납니다. 실제로 핵의 구형 모양의 경우
![]()
여기서 A = (36πV 2) 1/3 V는 결정의 한 분자당 부피입니다. 이전부터 핵이 N c = (2Aα/3Δμ) 3개의 분자를 포함할 때 ΔU는 최대 ΔUc = - N c Δμ + AN c 2/3 α에 도달합니다.
따라서 핵에 분자가 순차적으로 추가됨에 따라 시스템은 먼저 과냉각에 따라 높이 ΔU c로 잠재적인 언덕 꼭대기까지 올라야 하며, 그 후 결정에서 N의 추가 성장이 감소하여 발생합니다. 에너지, 즉 더 쉽습니다. 액체의 온도가 낮을수록, 즉 과냉각이 강할수록 결정화가 더 빨리 일어나는 것처럼 보입니다. 실제로 저체온증이 심하지 않은 경우에 해당됩니다. 그러나 t가 감소하면 액체의 점도도 기하급수적으로 증가하여 분자의 이동이 어려워집니다. 결과적으로 과냉각도가 높으면 결정화 과정이 수년 동안 지연될 수 있습니다(다양한 출처의 유리의 경우와 마찬가지로).
수치 추정에 따르면 자연 조건(Δt = 1~10°C)에서 정상적인 과냉각도의 물에 대해 배아는 수십 개의 분자로 구성되어야 하며 이는 액상의 배위수(~4.4)보다 훨씬 큽니다. ). 따라서 시스템은 에너지 언덕의 정상에 오르기 위해 많은 수의 변동 시도를 필요로 합니다. 완전히 정제되지 않은 물에서는 불순물 입자, 먼지 입자, 용기 벽의 불균일성 등이 될 수 있는 이미 존재하는 결정화 중심의 존재로 인해 강한 과냉각이 방지됩니다. 결과적으로 결정 성장의 동역학은 조건에 따라 달라집니다. 간기 경계 근처의 열 전달뿐만 아니라 원자 수준의 후자의 형태, 분자 수준.
심하게 과냉각된 물은 두 가지 특징적인 온도 t h = −36°C와 t g = −140°C를 갖습니다. 0°С > t > th 온도 범위에서 잘 정제되고 가스가 제거된 물은 오랫동안 과냉각된 액체 상태로 남아 있을 수 있습니다. tg에서< t < t h происходит гомогенное зарождение кристалликов льда, и вода не может находиться в переохлажденном состоянии при любой степени очистки. В условиях достаточно быстрого охлаждения при t < tg подвижность молекул воды настолько падает (а вязкость растет), что она образует стеклообразное твердое тело с аморфной структурой, свойственной жидкостям. При этом в области невысоких давлений образуется аморфная фаза низкой плотности, а в области повышенных – аморфная фаза высокой плотности, то есть вода демонстрирует полиаморфизм. При изменениях давления или температуры одна аморфная фаза скачком переходит в другую с неожиданно большим изменением плотности (>20%).
물 다형성의 본질에 대한 몇 가지 관점이 있습니다. 따라서 에 따르면 강하게 과냉각된 물의 이러한 거동은 두 H2O 분자 상호 작용의 잠재적 프로파일에 하나 이상의 최소값이 있다는 것을 받아들인다면 설명될 수 있습니다.

쌀. 5(에 의해 ). 가상 전위 프로파일: a – 하나의 에너지 최소값(예: Lennard-Jones 전위 U(r) = A/r 6 − B/r 12) 및 b – 두 개의 에너지 최소값(a의 두 가지 안정적인 구성에 해당) 분자 r H와 r L의 조건부 중심 사이의 거리가 서로 다른 두 개의 상호 작용하는 분자 물(1과 2)의 클러스터; 그 중 첫 번째는 밀도가 더 높은 단계에 해당하고, 두 번째는 밀도가 더 낮은 단계에 해당합니다.
그리고 두 개(그림 5). 그러면 밀도가 높은 비정질 상은 평균 거리 rH에 해당하고 밀도가 낮은 상은 rL에 해당합니다. 컴퓨터 모델링은 이러한 관점을 확증하지만, 이 가설에 대한 신뢰할 만한 실험적 증거는 아직 없으며, 과냉각수의 이러한 특이한 특성을 설명하기 위해 이중 우물 전위를 사용하는 타당성을 확인하는 엄격한 이론도 없습니다.
과냉각수의 거동은 여러 가지 이유로 큰 관심을 끌고 있습니다. 특히 우리나라와 관련된 기후 조건, 고위도에서의 항해 가능성 및 모드를 결정합니다. 인터페이스에서 동적 결정화 과정에서 불순물의 재분배, 전하의 분리 및 후속 완화, 넓은 주파수 대역의 전자기 복사 등을 동반하는 흥미롭지만 여전히 잘 이해되지 않은 많은 현상이 발생합니다. 고도로 과냉각된 액체는 우수하고 열역학적 평형과는 거리가 멀고 불안정성의 발달로 인해 다양한 차수와 크기의 수상돌기가 형성될 수 있는 시스템 거동의 모델 상황을 여러 번 쉽게 재현할 수 있습니다( 전형적인 대표자는 창문의 눈송이와 얼음 패턴입니다), 프랙탈의 동작을 생성하고 모델링하는 데 편리합니다.
언뜻 보면 얼음 녹는 과정이 결정화 과정보다 분석하기 더 쉬워 보입니다. 그러나 그들은 또한 많은 질문을 남깁니다. 예를 들어, 녹은 물은 적어도 식물, 동물, 인간과 같은 생물학적 대상과 관련하여 한동안 일반 물의 특성과 다른 특성을 가지고 있다고 널리 알려져 있습니다. 아마도 이러한 특징은 높은 화학적 순도(얼음 결정화 중 낮은 불순물 포집 계수로 인해), 용해된 가스 및 이온 함량의 차이, 액체의 다분자 클러스터에 얼음 구조가 저장되어 있기 때문일 수 있습니다. 단계. 그러나 저자는 현대의 물리적 방법으로 얻은 이에 대한 신뢰할 만한 정보를 갖고 있지 않습니다.
물, 얼음 및 상전이의 과정과 특성에 대한 외부 물리적 장, 특히 자기장의 영향 메커니즘을 분석하는 것은 그다지 어렵지 않습니다. 우리의 전체 삶은 지구 자기장의 지속적인 작용과 약한 변동 조건 하에서 이루어집니다. 의학에서의 자기생물학 및 자기 치료 방법은 수세기 동안 발전해 왔습니다. 마지막으로, 장치는 대량 생산되어 농업용 관개에 사용되는 물을 자화하는 데(생산성을 높이기 위해), 증기 보일러에 전력을 공급하는(스케일 형성 속도를 줄이기 위해) 등에 널리 사용됩니다. 그러나 이러한 경우와 기타 유사한 경우에서 자기장의 작용 메커니즘에 대한 만족스러운 물리적 설명은 아직 없습니다.
결론
물, 얼음 및 이들의 상호 위상 변화는 여전히 많은 미스터리로 가득 차 있습니다. 이를 해결하는 것은 매우 흥미로운 신체적 문제일 뿐만 아니라 인간의 건강 및 복지와 직접적인 관련이 있기 때문에 지구상의 삶에도 매우 중요합니다. 아마도 그들은 물질의 가장 단순하고 잘 알려진 화학적 조성의 물리적 특성 형성에서 전자 및 분자 구조의 역할에 대한 가장 눈에 띄는 예 중 하나를 제공할 것입니다.
문학:
1. Bogorodsky V.V., Gavrilo V.P. 얼음. L .: Gidrometeoizdat, 1980. 384 p.
2. Maeno N. 얼음의 과학. M .: Mir, 1988. 231 p.
3. 홉스 P.V. 얼음 물리학. 옥스포드: 대학. 언론, 1974. 864p.
4. 자트세피나 G.N. 물의 물리적 특성과 구조. M .: 모스크바 주립 대학 출판사, 1998. 184 p.
5. Mishima O., Stanley E. 액체, 과냉각수 및 유리질 물의 관계 // 자연. 1998. Vol. 396. pp. 329–335.
6. 졸로투킨 I.V. 고체 물리학의 프랙탈 // Soros Educational Journal. 1998. No. 7. pp. 108–113. 기사 검토자 B.A. 스트루코프
Yuri Ivanovich Golovin, 물리 및 수학 과학 박사, 교수, 교장. 탐보프 주립대학교 이론 및 실험 물리학과. G.R. 러시아 연방의 명예과학자 데르자빈(Derzhavin). 과학적 관심 분야는 고체 결함의 전자 구조와 이로 인해 발생하는 거시적 특성입니다. 단행본과 40개의 발명품을 포함하여 200개 이상의 과학 논문의 저자이자 공동 저자입니다.
얼음- 화학물질이 함유된 광물 공식 H 2 O는 결정 상태의 물을 나타냅니다.
얼음의 화학적 조성: H - 11.2%, O - 88.8%. 때로는 기체 및 고체 기계적 불순물이 포함되어 있습니다.
자연에서 얼음은 주로 여러 가지 결정 변형 중 하나로 표현되며, 녹는점은 0°C이고 0~80°C의 온도 범위에서 안정적입니다. 얼음과 비정질 얼음의 결정질 변형은 10가지로 알려져 있습니다. 가장 많이 연구된 것은 자연에서 발견되는 유일한 변형인 첫 번째 변형의 얼음입니다. 얼음은 얼음 자체의 형태(대륙, 부유, 지하 등)뿐만 아니라 눈, 서리 등의 형태로도 자연에서 발견됩니다.
또한보십시오:
구조
얼음의 결정 구조는 구조와 유사합니다. 각 H 2 0 분자는 가장 가까운 4개의 분자로 둘러싸여 있으며, 2.76A와 동일한 거리에 있고 정사면체의 꼭지점에 위치합니다. 배위수가 낮기 때문에 얼음 구조는 개방형이며 밀도(0.917)에 영향을 미칩니다. 얼음은 육각형 공간 격자를 갖고 있으며 물이 0°C, 대기압에서 얼면서 형성됩니다. 얼음의 모든 결정질 변형 격자는 사면체 구조를 가지고 있습니다. 얼음 단위 셀의 매개변수(t 0°C에서): a=0.45446 nm, c=0.73670 nm(c는 인접한 주 평면 사이 거리의 두 배입니다). 온도가 떨어지면 거의 변하지 않습니다. 얼음 격자의 H 2 0 분자는 수소 결합으로 서로 연결됩니다. 얼음 격자에서 수소 원자의 이동성은 산소 원자의 이동성보다 훨씬 높기 때문에 분자가 이웃을 변경합니다. 얼음 격자에서 분자의 상당한 진동 및 회전 운동이 있는 경우 공간 연결 부위에서 분자의 병진 점프가 발생하여 추가 질서를 방해하고 전위가 형성됩니다. 이는 얼음의 돌이킬 수 없는 변형(흐름)과 이를 유발한 응력(가소성, 점도, 항복 강도, 크리프 등) 사이의 관계를 특징으로 하는 얼음의 특정 유변학적 특성의 발현을 설명합니다. 이러한 상황으로 인해 빙하는 점성이 높은 액체와 유사하게 흐르므로 자연 얼음은 지구상의 물 순환에 적극적으로 참여합니다. 얼음 결정의 크기는 상대적으로 큽니다(가로 크기는 1밀리미터에서 수십 센티미터까지). 이는 점도 계수의 이방성을 특징으로 하며 그 값은 몇 배나 달라질 수 있습니다. 결정은 하중의 영향으로 방향을 바꿀 수 있으며, 이는 변성 및 빙하의 유속에 영향을 미칩니다.
속성

얼음은 무색이다. 큰 클러스터에서는 푸른 색조를 띕니다. 유리가 빛난다. 투명한. 분열이 없습니다. 경도 1.5. 부서지기 쉬운. 광학적으로 양성이며 굴절률이 매우 낮습니다(n = 1.310, nm = 1.309). 자연에는 14가지의 얼음 변형이 알려져 있습니다. 사실, 육각형 시스템에서 결정화되고 얼음 I로 지정되는 친숙한 얼음을 제외한 모든 것은 매우 낮은 온도(약 -110150 0C) 및 고압의 이국적인 조건에서 형성됩니다. 육각형과는 다른 분자 변화와 시스템이 형성됩니다. 이러한 조건은 우주에서의 조건과 유사하며 지구에서는 발생하지 않습니다. 예를 들어, -110°C 미만의 온도에서 수증기는 팔면체 형태로 금속판에 침전되고 크기는 수 나노미터입니다. 이것이 소위 입방체 얼음입니다. 온도가 -110°C보다 약간 높고 증기 농도가 매우 낮으면 매우 조밀한 비정질 얼음층이 판에 형성됩니다.
형태

얼음은 자연에서 매우 흔한 광물입니다. 지각에는 강, 호수, 바다, 땅, 전나무, 빙하 등 여러 유형의 얼음이 있습니다. 더 자주 미세 결정질 입자의 집합체 클러스터를 형성합니다. 승화, 즉 증기 상태에서 직접 발생하는 결정질 얼음 형성도 알려져 있습니다. 이러한 경우 얼음은 골격 결정(눈송이)과 골격 및 수지상 성장의 집합체(동굴 얼음, 흰 서리, 흰 서리 및 유리의 패턴)로 나타납니다. 크고 잘 절단된 결정이 발견되지만 매우 드물게 발견됩니다. N. N. Stulov는 표면으로부터 55-60m 깊이에서 발견되는 러시아 북동부의 얼음 결정을 묘사했으며 등각 투영 및 원주 모양을 가지며 가장 큰 결정의 길이는 60cm이고 바닥의 직경은 15cm 얼음결정의 단순한 형태에서는 육각기둥(1120), 육각쌍각뿔(1121), 피나코이드(0001)의 면만 확인되었다.
흔히 '고드름'이라고 불리는 얼음 종유석은 누구에게나 친숙합니다. 가을-겨울철에는 약 0°의 온도차가 있으며, 흐르는 물과 떨어지는 물의 느린 결빙(결정화)으로 지구 표면 어디에서나 자랍니다. 얼음 동굴에서도 흔히 볼 수 있습니다.
얼음둑은 저수지 가장자리를 따라 물과 공기의 경계에서 결정화되고 웅덩이 가장자리, 강둑, 호수, 연못, 저수지 등의 경계를 이루는 얼음으로 만들어진 얼음 덮개 조각입니다. 나머지 물 공간은 얼지 않습니다. 완전히 함께 자라면 저수지 표면에 연속적인 얼음 덮개가 형성됩니다.
얼음은 또한 다공성 토양에서 섬유질 정맥의 형태로 평행한 기둥 모양의 집합체를 형성하고 그 표면에는 얼음 안톨라이트를 형성합니다.
기원

공기 온도가 떨어지면 주로 물통에 얼음이 형성됩니다. 동시에 얼음 바늘로 구성된 얼음죽이 물 표면에 나타납니다. 아래에서는 긴 얼음 결정이 자라는데, 그 6차 대칭축은 지각 표면에 수직으로 위치합니다. 다양한 형성 조건에서 얼음 결정 사이의 관계가 그림 1에 나와 있습니다. 얼음은 습기가 있고 온도가 0°C 아래로 떨어지는 곳이면 어디에서나 흔히 볼 수 있습니다. 일부 지역에서는 지상 얼음이 얕은 깊이까지만 녹고 그 아래에서는 영구 동토층이 시작됩니다. 이들은 소위 영구 동토층 지역입니다. 지각 상층의 영구 동토층 분포 지역에는 소위 지하 얼음이 발견되며 그중 현대 및 화석 지하 얼음이 구별됩니다. 지구 전체 육지 면적의 최소 10%는 빙하로 덮여 있으며, 이를 구성하는 단일체 얼음 암석을 빙하라고 합니다. 빙하 얼음은 주로 눈이 압축되고 변형되면서 형성됩니다. 빙상은 그린란드의 약 75%와 남극 대륙의 거의 전부를 덮고 있습니다. 가장 큰 빙하 두께(4330m)는 버드 스테이션(남극 대륙) 근처에 있습니다. 그린란드 중부에서는 얼음 두께가 3200m에 이릅니다.
얼음 퇴적물은 잘 알려져 있습니다. 춥고 긴 겨울과 짧은 여름이 있는 지역과 높은 산악 지역에는 종유석과 석순이 있는 얼음 동굴이 형성되며, 그중 가장 흥미로운 곳은 우랄 페름 지역의 Kungurskaya와 Dobshine 동굴입니다. 슬로바키아.
바닷물이 얼면 해빙이 형성됩니다. 해빙의 특징적인 특성은 염분도와 다공성으로, 밀도 범위는 0.85~0.94g/cm 3 입니다. 밀도가 낮기 때문에 빙원은 두께의 1/7-1/10만큼 수면 위로 올라갑니다. 해빙은 -2.3°C 이상의 온도에서 녹기 시작합니다. 민물 얼음보다 더 탄력 있고 조각으로 부서지기가 더 어렵습니다.
애플리케이션

1980년대 후반에 아르곤 연구소는 얼음이 쌓이거나 서로 달라붙거나 냉각 시스템을 막지 않고 다양한 직경의 파이프를 통해 자유롭게 흐를 수 있는 얼음 슬러리를 만드는 기술을 개발했습니다. 짠물 현탁액은 매우 작은 둥근 모양의 얼음 결정으로 구성되어 있습니다. 덕분에 물의 이동성이 유지되는 동시에 열 공학적 관점에서 볼 때 이는 건물의 냉각 시스템에서 단순 냉수보다 5~7배 더 효과적인 얼음을 의미합니다. 또한, 이러한 혼합물은 의학에도 유망합니다. 동물 실험에 따르면 얼음 혼합물의 미세 결정은 매우 작은 혈관으로 완벽하게 통과하여 세포를 손상시키지 않는 것으로 나타났습니다. "Icy Blood"는 피해자를 구출할 수 있는 시간을 연장합니다. 심정지의 경우 보수적인 추정에 따르면 이 시간이 10~15분에서 30~45분으로 길어진다고 가정해 보겠습니다.
구조 재료로 얼음을 사용하는 것은 주거지 건설을 위해 극지방에서 널리 퍼져 있습니다 - 이글루. 얼음은 D. Pike가 제안한 Pikerit 소재의 일부로, 이를 통해 세계 최대 항공모함을 만들도록 제안되었습니다.
얼음 - H 2 O
분류
| 스트룬츠(8판) | 4/A.01-10 |
| 니켈-스트룬츠(10판) | 4.AA.05 |
| 다나(8판) | 4.1.2.1 |
| 안녕하세요 CIM Ref. | 7.1.1 |