Структура на водата. Свойства на водата Основните разлики между леда и водата на молекулярно ниво
От 14-те известни форми на твърда вода в природата откриваме само една - лед. Останалите се образуват при екстремни условия и са недостъпни за наблюдения извън специални лаборатории. Най-интригуващото свойство на леда е неговото невероятно разнообразие от външни прояви. С една и съща кристална структура може да изглежда напълно различно, приемайки формата на прозрачни градушки и ледени висулки, люспи от пухкав сняг, плътна лъскава кора от фирн върху снежно поле или гигантски ледникови маси.
В малкия японски град Кага, разположен на западния бряг на остров Хоншу, има необичаен музей. Сняг и лед. Основан е от Укихиро Накая, първият човек, който се е научил да отглежда изкуствени снежинки в лабораторията, красиви като падащите от небето. В този музей посетителите са заобиколени от всички страни с правилни шестоъгълници, защото именно тази „шестоъгълна“ симетрия е характерна за обикновените ледени кристали (между другото, гръцката дума кристалос всъщност означава „лед“). Той определя много от неговите уникални свойства и кара снежинките, с цялото им безкрайно разнообразие, да растат във формата на звезди с шест, по-рядко с три или дванадесет лъча, но никога с четири или пет.
Молекули в ажур
Ключът към структурата на твърдата вода се крие в структурата на нейната молекула. H2O може да се представи опростено като тетраедър (пирамида с триъгълна основа). В центъра има кислород, в два върха има водород, по-точно протон, чиито електрони участват в образуването на ковалентна връзка с кислорода. Останалите два върха са заети от двойки кислородни валентни електрони, които не участват в образуването на вътрешномолекулни връзки, поради което се наричат самотни.
Когато протон на една молекула взаимодейства с двойка самотни кислородни електрони на друга молекула, се образува водородна връзка, по-малко силна от вътрешномолекулната връзка, но достатъчно мощна, за да задържи съседните молекули заедно. Всяка молекула може едновременно да образува четири водородни връзки с други молекули под строго определени ъгли, които не позволяват създаването на плътна структура при замразяване. Тази невидима рамка от водородни връзки подрежда молекулите в дантелена мрежа с кухи канали. Веднага щом ледът се нагрее, дантелата се срутва: водните молекули започват да падат в кухините на мрежата, което води до по-плътна структура на течността, поради което водата е по-тежка от леда.Ледът, който се образува при атмосферно налягане и се топи при 0°C, е най-често срещаното, но все още не напълно разбрано вещество. Много в неговата структура и свойства изглежда необичайно. В местата на кристалната решетка на леда кислородните атоми са подредени по подреден начин, образувайки правилни шестоъгълници, но водородните атоми заемат различни позиции по дължината на връзките. Това поведение на атомите като цяло е нетипично - като правило, в твърдо вещество всички се подчиняват на един и същ закон: или всички атоми са подредени по подреден начин и тогава това е кристал, или произволно, и тогава това е аморфно вещество.
Ледът се топи трудно, колкото и странно да звучи. Ако нямаше водородни връзки, държащи водните молекули заедно, тя щеше да се стопи при 90°C. В същото време, когато водата замръзне, тя не намалява обема си, както се случва с повечето известни вещества, а се увеличава поради образуването на ажурна структура от лед.„Странностите“ на леда също включват генерирането на електромагнитно излъчване от растящите му кристали. Отдавна е известно, че повечето от примесите, разтворени във вода, не се прехвърлят в леда, когато той започне да расте; с други думи, той замръзва. Следователно, дори и върху най-мръсната локва, леденият филм е чист и прозрачен. Примесите се натрупват на границата между твърда и течна среда под формата на два слоя електрически заряди с различни знаци, които причиняват значителна потенциална разлика. Зареденият слой от примеси се движи заедно с долната граница на младия лед и излъчва електромагнитни вълни. Благодарение на това процесът на кристализация може да се наблюдава в детайли. По този начин кристалът, който расте по дължина под формата на игла, излъчва различно от този, покрит със странични израстъци, а излъчването на растящите зърна се различава от това, което се получава, когато кристалите се напукат. По формата, последователността, честотата и амплитудата на радиационните импулси може да се определи с каква скорост замръзва ледът и каква структура на леда се получава.
Грешен лед
В твърдо състояние водата има според последните данни 14 структурни модификации. Някои от тях са кристални (по-голямата част от тях), други са аморфни, но всички те се различават един от друг по относителното разположение на водните молекули и свойства. Вярно, всичко освен познатия ни лед се образува при екзотични условия – при много ниски температури и високо налягане, когато ъглите на водородните връзки във водната молекула се променят и се образуват системи, различни от шестоъгълните. Например при температури под 110°C водните пари се утаяват върху метална плоча под формата на октаедри и кубчета с размери няколко нанометра – това е така нареченият кубичен лед. Ако температурата е малко над 110° и концентрацията на пари е много ниска, върху плочата се образува слой от изключително плътен аморфен лед.
Последните две модификации на лед XIII и XIV бяха открити от учени от Оксфорд съвсем наскоро, през 2006 г. 40-годишното предсказание, че трябва да съществуват ледени кристали с моноклинни и ромбични решетки, беше трудно да се потвърди: вискозитетът на водата при температура от 160 ° C е много висок и молекулите на свръхчистата преохладена вода се събират в такива количества да се образува кристално ядро, трудно. Катализаторът помогна: солна киселина, която увеличи мобилността на водните молекули при ниски температури. Такива модификации на лед не могат да се образуват в земната природа, но могат да се търсят в замръзналите спътници на други планети.
Така реши комисиятаСнежинката е единичен кристал от лед, вариация на темата за шестоъгълен кристал, но който расте бързо при неравновесни условия. Най-любознателните умове от векове се борят с тайната на тяхната красота и безкрайно разнообразие. Астрономът Йоханес Кеплер е написал цял трактат „За шестоъгълните снежинки“ през 1611 г. През 1665 г. Робърт Хук, в огромен обем от скици на всичко, което е видял с микроскоп, публикува много рисунки на снежинки с различни форми. Първата успешна снимка на снежинка под микроскоп е направена през 1885 г. от американския фермер Уилсън Бентли. Оттогава не можеше да спре. До края на живота си, повече от четиридесет години, Бентли ги снима. Повече от пет хиляди кристала и нито един не е същият.
Най-известните последователи на каузата на Бентли са вече споменатият Укихиро Накая и американският физик Кенет Либрехт. Накая беше първият, който предположи, че размерът и формата на снежинките зависят от температурата на въздуха и съдържанието на влага, и блестящо потвърди тази хипотеза експериментално чрез отглеждане на ледени кристали с различни форми в лабораторията. И Либрехт дори започна да отглежда направени по поръчка снежинки с предварително определена форма.
Животът на снежинката започва с образуването на кристални ледени ядра в облак от водна пара, докато температурата пада. Центърът на кристализация може да бъде прахови частици, всякакви твърди частици или дори йони, но във всеки случай тези парчета лед с размер по-малък от една десета от милиметъра вече имат шестоъгълна кристална решетка.
Водните пари, кондензиращи върху повърхността на тези ядра, първо образуват малка шестоъгълна призма, от шестте ъгъла на която започват да растат напълно еднакви ледени игли и странични израстъци. Те са еднакви просто защото температурата и влажността около ембриона също са еднакви. На тях от своя страна растат странични издънки и клони, като на дърво. Такива кристали се наричат дендрити, тоест подобни на дърво.
Движейки се нагоре и надолу в облак, снежинката се натъква на условия с различни температури и концентрации на водна пара. Формата му се променя, подчинявайки се до последно на законите на шестоъгълната симетрия. Ето как снежинките стават различни. Въпреки че теоретично, в един и същ облак на една и съща надморска височина, те могат да „изплуват“ идентични. Но всеки има свой собствен път до земята, който е доста дълъг; средно една снежинка пада със скорост 0,9 км в час. Това означава, че всеки има своя собствена история и своя окончателна форма. Ледът, който образува снежинка, е прозрачен, но когато има много, слънчевата светлина, отразена и разпръсната върху многобройни лица, ни създава впечатлението за бяла непрозрачна маса - наричаме я сняг.
За да избегне объркване с разнообразието от снежинки, Международната комисия по сняг и лед прие през 1951 г. доста проста класификация на ледените кристали: плочи, звездни кристали, колони или колони, игли, пространствени дендрити, колони с връх и неправилни форми. И още три вида ледени валежи: фин сняг, лед и градушка.Растежът на скреж, скреж и шарки върху стъклото се подчинява на същите закони. Тези явления, като снежинките, се образуват от кондензация, молекула по молекула, върху земята, тревата, дърветата. Шарките на прозореца се появяват в мразовито време, когато влагата от топъл стаен въздух кондензира върху повърхността на стъклото. Но градушката се образува, когато капки вода замръзнат или когато лед в облаци, наситени с водна пара, замръзне на плътни слоеве върху зародишите на снежинките. Други, вече образувани снежинки могат да замръзнат върху градушката, сливайки се с нея, поради което градушката придобива най-странни форми.
За нас на Земята е достатъчна една твърда модификация на водата - обикновен лед. Той буквално прониква във всички области на човешкото обитаване или престой. Събирайки се в огромни количества, снегът и ледът образуват специални структури със свойства, коренно различни от тези на отделните кристали или снежинки. Планинските ледници, ледените покрития на водните площи, вечната замръзналост и просто сезонната снежна покривка значително влияят върху климата на големи региони и планетата като цяло: дори тези, които никога не са виждали сняг, усещат дъха на неговите маси, натрупани на полюсите на Земята, за например под формата на дългосрочни колебания в нивото на Световния океан. А ледът е толкова важен за външния вид на нашата планета и комфортното местообитание на живите същества на нея, че учените са отделили специална среда за него - криосферата, която се простира високо в атмосферата и дълбоко в земната кора.
Олга Максименко, кандидат на химическите науки
Персонализирано търсене
Водна структура
Доцент доктор. О.В. Мосин
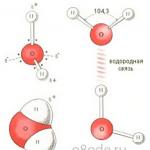
Водната молекула е малък дипол, съдържащ положителни и отрицателни заряди на своите полюси. Тъй като масата и зарядът на кислородното ядро са по-големи от тези на водородните ядра, електронният облак се изтегля към кислородното ядро. В този случай водородните ядра са изложени. Така електронният облак има неравномерна плътност. В близост до водородните ядра има липса на електронна плътност, а от противоположната страна на молекулата, близо до кислородното ядро, има излишък на електронна плътност. Именно тази структура определя полярността на водната молекула. Ако свържете епицентровете на положителните и отрицателните заряди с прави линии, ще получите триизмерна геометрична фигура - правилен тетраедър.
 Структурата на водната молекула (снимка вдясно)
Структурата на водната молекула (снимка вдясно)
Поради наличието на водородни връзки, всяка водна молекула образува водородна връзка с 4 съседни молекули, образувайки ажурна мрежеста рамка в ледената молекула. В течно състояние обаче водата е неподредена течност; Тези водородни връзки са спонтанни, краткотрайни, бързо се разкъсват и се образуват отново. Всичко това води до разнородност в структурата на водата.
 Водородни връзки между водните молекули (снимката долу вляво)
Водородни връзки между водните молекули (снимката долу вляво)
Фактът, че водата е разнороден по състав, е установен отдавна. Отдавна е известно, че ледът плува на повърхността на водата, тоест плътността на кристалния лед е по-малка от плътността на течността.
За почти всички други вещества кристалът е по-плътен от течната фаза. Освен това, дори след топене, с повишаване на температурата, плътността на водата продължава да се увеличава и достига максимум при 4C. По-малко известна е аномалията на свиваемостта на водата: при нагряване от точката на топене до 40°С тя намалява и след това се увеличава. Топлинният капацитет на водата също зависи немонотонно от температурата.
В допълнение, при температури под 30 ° С, с повишаване на налягането от атмосферното до 0,2 GPa, вискозитетът на водата намалява и коефициентът на самодифузия, параметър, който определя скоростта на движение на водните молекули една спрямо друга, се увеличава.
При други течности връзката е обратна и почти никъде не се случва някой важен параметър да се държи немонотонно, т.е. първо се повишава, а след преминаване на критична стойност на температурата или налягането намалява. Възникна предположение, че всъщност водата не е една течност, а смес от два компонента, които се различават по свойства, например плътност и вискозитет, и следователно структура. Подобни идеи започват да възникват в края на 19 век, когато се натрупват много данни за водните аномалии.
Уайтинг е първият, който предлага идеята, че водата се състои от два компонента през 1884 г. Неговото авторство е цитирано от EF Fritsman в монографията "Природата на водата. Тежка вода", публикувана през 1935 г. През 1891 г. V. Rengten въвежда концепцията за две състояния на водата, които се различават по плътност. След него се появяват много произведения, в които водата се разглежда като смес от асоциации с различен състав (хидроли).
Когато структурата на леда беше определена през 20-те години на миналия век, се оказа, че водните молекули в кристално състояние образуват триизмерна непрекъсната мрежа, в която всяка молекула има четири най-близки съседи, разположени във върховете на правилен тетраедър. През 1933 г. J. Bernal и P. Fowler предполагат, че подобна мрежа съществува в течна вода. Тъй като водата е по-плътна от леда, те смятат, че молекулите в нея са подредени не като в леда, тоест като силициевите атоми в минерала тридимит, а като силициевите атоми в по-плътна модификация на силициев диоксид, кварц. Увеличаването на плътността на водата при нагряване от 0 до 4C се обяснява с наличието на тридимитния компонент при ниски температури. Така моделът на Бернал Фаулър запазва елемента на двуструктурата, но основното им постижение е идеята за непрекъсната тетраедрична мрежа. Тогава се появи известният афоризъм на И. Лангмюр: „Океанът е една голяма молекула“. Прекомерната спецификация на модела не увеличи броя на привържениците на теорията на единната мрежа.
Едва през 1951 г. J. Pople създава модел на непрекъсната решетка, който не е толкова специфичен като модела на Бернал Фаулър. Попъл си представяше водата като произволна тетраедрична мрежа, връзките между молекулите в която са извити и имат различна дължина. Моделът на Pople обяснява уплътняването на водата по време на топенето чрез огъване на връзките. Когато през 60-70-те години се появиха първите определения за структурата на ледовете II и IX, стана ясно как огъването на връзките може да доведе до уплътняване на структурата. Моделът на Pople не може да обясни немонотонната зависимост на свойствата на водата от температурата и налягането, както и моделите с две състояния. Следователно идеята за две държави се споделя от много учени дълго време.
Но през втората половина на 20-ти век беше невъзможно да се фантазира за състава и структурата на хидролите, както в началото на века. Вече беше известно как действат ледът и кристалните хидрати и знаеха много за водородните връзки. В допълнение към моделите на континуума (модел на Попъл) се появиха две групи смесени модели: клъстерни и клатратни. В първата група водата се появява под формата на клъстери от молекули, свързани с водородни връзки, които се носят в море от молекули, които не участват в такива връзки. Втората група модели третира водата като непрекъсната мрежа (обикновено наричана рамка в този контекст) от водородни връзки, които съдържат кухини; те съдържат молекули, които не образуват връзки с молекулите на рамката. Не беше трудно да се изберат свойствата и концентрациите на две микрофази на клъстерните модели или свойствата на рамката и степента на запълване на нейните кухини на клатратните модели, за да се обяснят всички свойства на водата, включително известните аномалии.
Сред клъстерните модели най-ярък беше моделът на Г. Немети и Х. Шераги: Предложените от тях снимки, изобразяващи клъстери от свързани молекули, плаващи в море от несвързани молекули, бяха включени в много монографии.
Първият модел от клатратен тип е предложен през 1946 г. от О. Я. Самойлов: във водата се запазва мрежа от водородни връзки, подобна на хексагонален лед, чиито кухини са частично запълнени с мономерни молекули. L. Pauling през 1959 г. създава друга опция, предполагайки, че основата на структурата може да бъде мрежа от връзки, присъщи на някои кристални хидрати.
През втората половина на 60-те и началото на 70-те години се наблюдава сближаване на всички тези възгледи. Появиха се варианти на клъстерни модели, при които молекулите в двете микрофази са свързани с водородни връзки. Поддръжниците на клатратните модели започнаха да допускат образуването на водородни връзки между празните и структурните молекули. Тоест всъщност авторите на тези модели разглеждат водата като непрекъсната мрежа от водородни връзки. И ние говорим за това колко разнородна е тази мрежа (например по плътност). Идеята за водата като клъстери с водородни връзки, плаващи в море от несвързани водни молекули, беше сложен край в началото на осемдесетте години, когато Г. Стенли приложи теорията за просмукване, която описва фазовите преходи на водата, към воден модел.
През 1999 г. известният руски изследовател на водата С.В. Зенин защитава докторската си дисертация в Института по медицински и биологични проблеми на Руската академия на науките по теория на клъстерите, което е значителна стъпка в напредъка на тази област на изследване, чиято сложност се засилва от факта, че те са в пресечната точка на три науки: физика, химия и биология. Въз основа на данни, получени чрез три физикохимични метода: рефрактометрия (S.V. Zenin, B.V. Tyaglov, 1994), високоефективна течна хроматография (S.V. Zenin et al., 1998) и протонен магнитен резонанс (C. S.V. Zenin, 1993) конструира и доказа геометрична модел на основното стабилно структурно образуване на водни молекули (структурирана вода), а след това (S.V. Zenin, 2004) е получено изображение на тези структури с помощта на контрастно-фазов микроскоп.
 Науката вече е доказала, че особеностите на физичните свойства на водата и множеството краткотрайни водородни връзки между съседните водородни и кислородни атоми във водната молекула създават благоприятни възможности за образуването на специални свързани структури (клъстери), които възприемат, съхраняват и предават голямо разнообразие от информация.
Науката вече е доказала, че особеностите на физичните свойства на водата и множеството краткотрайни водородни връзки между съседните водородни и кислородни атоми във водната молекула създават благоприятни възможности за образуването на специални свързани структури (клъстери), които възприемат, съхраняват и предават голямо разнообразие от информация.
Структурната единица на такава вода е клъстер, състоящ се от клатрати, чиято природа се определя от кулонови сили на далечни разстояния. Структурата на клъстерите кодира информация за взаимодействията, които са се случили с тези водни молекули. Във водните клъстери, поради взаимодействието между ковалентни и водородни връзки между кислородни атоми и водородни атоми, миграцията на протон (H+) може да се случи чрез релеен механизъм, което води до делокализация на протона в клъстера.
Водата, състояща се от множество клъстери от различни видове, образува йерархична пространствена течнокристална структура, която може да възприема и съхранява огромни количества информация.
Фигурата (V.L. Voeikov) показва диаграми на няколко прости клъстерни структури като пример.
Някои възможни структури на водни клъстери

Физически полета от много различно естество могат да бъдат носители на информация. По този начин е установена възможността за дистанционно информационно взаимодействие на течнокристалната структура на водата с обекти от различно естество с помощта на електромагнитни, акустични и други полета. Обектът на въздействие може да бъде и човек.
Водата е източник на свръхслабо и слабо променливо електромагнитно излъчване. Най-малко хаотичното електромагнитно излъчване се създава от структурирана вода. В този случай може да възникне индукция на съответното електромагнитно поле, което променя структурните и информационните характеристики на биологичните обекти.
През последните години бяха получени важни данни за свойствата на преохладената вода. Изследването на водата при ниски температури е много интересно, тъй като тя може да бъде преохладена повече от други течности. Кристализацията на водата, като правило, започва върху някакви нехомогенности или по стените на съда, или върху плаващи частици от твърди примеси. Следователно не е лесно да се намери температурата, при която преохладената вода би кристализирала спонтанно. Но учените успяха да направят това и сега температурата на така наречената хомогенна нуклеация, когато образуването на ледени кристали се извършва едновременно в целия обем, е известна за налягания до 0,3 GPa, тоест покриващи областите на съществуване на лед II.
От атмосферното налягане до границата, разделяща ледовете I и II, тази температура пада от 231 до 180 K и след това леко се повишава до 190 K. Под тази критична температура течната вода е невъзможна по принцип.
Ледена структура (снимка вдясно)
 Има обаче една мистерия, свързана с тази температура. В средата на осемдесетте години беше открита нова модификация на аморфен лед - лед с висока плътност и това помогна да се съживи идеята за водата като смес от две състояния. Като прототипи се считат не кристални структури, а структури от аморфен лед с различна плътност. Тази концепция е формулирана в най-ясна форма от Е. Г. Понятовски и В. В. Синицин, които пишат през 1999 г.: „Водата се разглежда като закономерен разтвор на два компонента, локалните конфигурации в които съответстват на късия ред на модификации на аморфен лед .” Освен това, чрез изучаване на реда на къси разстояния в преохладена вода при високо налягане, използвайки методи на неутронна дифракция, учените успяха да намерят компоненти, съответстващи на тези структури.
Има обаче една мистерия, свързана с тази температура. В средата на осемдесетте години беше открита нова модификация на аморфен лед - лед с висока плътност и това помогна да се съживи идеята за водата като смес от две състояния. Като прототипи се считат не кристални структури, а структури от аморфен лед с различна плътност. Тази концепция е формулирана в най-ясна форма от Е. Г. Понятовски и В. В. Синицин, които пишат през 1999 г.: „Водата се разглежда като закономерен разтвор на два компонента, локалните конфигурации в които съответстват на късия ред на модификации на аморфен лед .” Освен това, чрез изучаване на реда на къси разстояния в преохладена вода при високо налягане, използвайки методи на неутронна дифракция, учените успяха да намерят компоненти, съответстващи на тези структури.
Последица от полиморфизма на аморфния лед също доведе до предположения за разделянето на водата на два несмесващи се компонента при температури под хипотетичната критична точка при ниска температура. За съжаление, според изследователите, тази температура при налягане от 0,017 GPa е 230 K под температурата на нуклеация, така че никой все още не е успял да наблюдава стратификацията на течната вода. Така възраждането на модела с две състояния повдигна въпроса за хетерогенността на мрежата от водородни връзки в течна вода. Тази хетерогенност може да бъде разбрана само чрез компютърно моделиране.
Говорейки за кристалната структура на водата, трябва да се отбележи, че са известни 14 модификации на лед,повечето от които не се срещат в природата, в които водните молекули едновременно запазват своята индивидуалност и са свързани чрез водородни връзки. От друга страна, има много варианти на мрежата от водородни връзки в клатратните хидрати. Енергиите на тези мрежи (ледове с високо налягане и клатратни хидрати) не са много по-високи от енергиите на кубични и шестоъгълни ледове. Следователно фрагменти от такива структури могат да се появят и в течна вода. Възможно е да се конструират безброй различни непериодични фрагменти, чиито молекули имат четири най-близки съседи, разположени приблизително във върховете на тетраедъра, но тяхната структура не съответства на структурите на известни модификации на леда. Както показват многобройни изчисления, енергиите на взаимодействие на молекулите в такива фрагменти ще бъдат близки една до друга и няма причина да се твърди, че някаква структура трябва да преобладава в течна вода.
Структурните изследвания на водата могат да бъдат изследвани с помощта на различни методи;протонна магнитно-резонансна спектроскопия, инфрачервена спектроскопия, рентгенова дифракция и др. Например, дифракцията на рентгенови лъчи и неутрони е изследвана многократно. Тези експерименти обаче не могат да предоставят подробна информация за структурата. Нехомогенности, които се различават по плътност, могат да се видят чрез разсейване на рентгенови лъчи и неутрони под малки ъгли, но такива нехомогенности трябва да са големи, състоящи се от стотици водни молекули. Би било възможно да ги видите чрез изучаване на разсейването на светлината. Водата обаче е изключително бистра течност. Единственият резултат от дифракционните експерименти е функцията на радиалното разпределение, тоест разстоянието между атомите кислород, водород и кислород-водород. От тях става ясно, че няма далечен ред в подреждането на водните молекули. Тези функции се разпадат много по-бързо за водата, отколкото за повечето други течности. Например, разпределението на разстоянията между кислородните атоми при температури, близки до стайната, дава само три максимума, при 2,8, 4,5 и 6,7. Първият максимум съответства на разстоянието до най-близките съседи и стойността му е приблизително равна на дължината на водородната връзка. Вторият максимум е близо до средната дължина на ръба на тетраедър: не забравяйте, че водните молекули в шестоъгълния лед са разположени по върховете на тетраедър, описан около централната молекула. И третият максимум, много слабо изразен, съответства на разстоянието до трети и по-далечни съседи във водородната мрежа. Самият този максимум не е много ярък и няма нужда да говорим за следващи пикове. Има опити да се получи по-подробна информация от тези разпределения. Така през 1969 г. И. С. Андрианов и И. З. Фишър намират разстоянията до осмия съсед, докато до петия съсед се оказва 3, а до шестия 3,1. Това дава възможност да се получат данни за далечната среда на водните молекули.
Друг метод за изследване на структурата - неутронна дифракция върху водни кристали - се извършва точно по същия начин като рентгеновата дифракция. Въпреки това, поради факта, че дължините на разсейване на неутрони не се различават толкова много между различните атоми, методът на изоморфно заместване става неприемлив. На практика обикновено се работи с кристал, чиято молекулна структура вече е приблизително определена с други методи. След това се измерват интензитетите на неутронна дифракция за този кристал. Въз основа на тези резултати се извършва трансформация на Фурие, по време на която се използват измерените неутронни интензитети и фази, изчислени, като се вземат предвид неводородните атоми, т.е. кислородни атоми, чиято позиция в структурния модел е известна. Тогава на картата на Фурие, получена по този начин, атомите на водорода и деутерия са представени с много по-големи тегла, отколкото на картата на електронната плътност, т.к. приносът на тези атоми за разсейването на неутрони е много голям. Използвайки тази карта на плътността, можете например да определите позициите на водородните атоми (отрицателна плътност) и деутерий (положителна плътност).
Възможен е вариант на този метод, който се състои в това, че образуваният във вода кристал се държи в тежка вода преди измерванията. В този случай неутронната дифракция не само дава възможност да се определи къде се намират водородните атоми, но също така идентифицира онези от тях, които могат да бъдат обменени с деутерий, което е особено важно при изследване на изотопния (H-D) обмен. Такава информация помага да се потвърди, че структурата е установена правилно.
Други методи също позволяват да се изследва динамиката на водните молекули. Това са експерименти за квазиеластично разсейване на неутрони, ултрабърза инфрачервена спектроскопия и изследване на водна дифузия с помощта на ЯМР или белязани атоми на деутерий. Методът на ЯМР спектроскопията се основава на факта, че ядрото на водородния атом има магнитен момент - спин - който взаимодейства с магнитни полета, постоянни и променливи. По ЯМР спектъра може да се съди в каква среда се намират тези атоми и ядра, като по този начин се получава информация за структурата на молекулата.
В резултат на експерименти по квазиеластично разсейване на неутрони във водни кристали беше измерен най-важният параметър - коефициентът на самодифузия при различни налягания и температури. За да се прецени коефициентът на самодифузия от квазиеластичното разсейване на неутрони, е необходимо да се направи предположение за природата на молекулярното движение. Ако те се движат в съответствие с модела на Я. И. Френкел (известен руски физик-теоретик, автор на „Кинетичната теория на течностите” - класическа книга, преведена на много езици), наричан още модел на „изчакване на скока”, тогава времето на установен живот (времето между прескачането) на една молекула е 3,2 пикосекунди. Най-новите методи на фемтосекундна лазерна спектроскопия позволиха да се оцени продължителността на живота на прекъсната водородна връзка: на протон са необходими 200 fs, за да намери партньор. Все пак това са средни стойности. Възможно е да се изследват детайлите на структурата и природата на движението на водните молекули само с помощта на компютърна симулация, понякога наричана числен експеримент.

Ето как изглежда структурата на водата според резултатите от компютърното моделиране (според доктора на химическите науки Г.Г. Маленков). Общата неподредена структура може да бъде разделена на два типа региони (показани като тъмни и светли топки), които се различават по своята структура, например по обема на полиедъра на Вороной (а), степента на тетраедричност на непосредствената среда ( b), стойността на потенциалната енергия (c), а също и в присъствието на четири водородни връзки във всяка молекула (d). Тези зони обаче буквално в един момент, след няколко пикосекунди, ще сменят местоположението си.
Симулацията се извършва по следния начин. Ледената структура се взема и се нагрява, докато се разтопи. След това, след известно време, за да забрави водата за кристалния си произход, се правят моментални микроснимки.
За анализ на структурата на водата се избират три параметъра:
- степен на отклонение на локалната среда на молекулата от върховете на правилния тетраедър;
-потенциална енергия на молекулите;
-обемът на така наречения полиедър на Вороной.
За да конструирате този полиедър, вземете ръб от дадена молекула до най-близката, разделете го наполовина и начертайте равнина през тази точка, перпендикулярна на ръба. Това дава обема на молекула. Обемът на полиедъра е плътност, тетраедричността е степента на изкривяване на водородните връзки, енергията е степента на стабилност на молекулната конфигурация. Молекулите с подобни стойности на всеки от тези параметри са склонни да се групират заедно в отделни клъстери. Както регионите с ниска плътност, така и регионите с висока плътност имат различни енергийни стойности, но могат да имат и еднакви енергийни стойности. Експериментите показват, че области с различна структура, клъстери възникват спонтанно и спонтанно се разпадат. Цялата структура на водата е жива и непрекъснато се променя, а времето, през което се случват тези промени, е много кратко. Изследователите наблюдават движенията на молекулите и откриват, че те извършват неравномерни вибрации с честота от около 0,5 ps и амплитуда от 1 ангстрьом. Наблюдавани са и редки бавни скокове на ангстрьоми, които продължават пикосекунди. Като цяло, за 30 ps една молекула може да се движи 8-10 ангстрьома. Животът на местната среда също е кратък. Региони, съставени от молекули с подобни стойности на обема на полиедъра на Вороной, могат да се разпаднат за 0,5 ps или могат да живеят няколко пикосекунди. Но разпределението на продължителността на живота на водородната връзка е много голямо. Но това време не надвишава 40 ps, а средната стойност е няколко ps.
В заключение следва да се подчертае, че Теорията за клъстерната структура на водата има много клопки.Например Зенин предполага, че основният структурен елемент на водата е клъстер от 57 молекули, образувани от сливането на четири додекаедъра. Те имат общи лица, а центровете им образуват правилен тетраедър. Отдавна е известно, че водните молекули могат да бъдат разположени във върховете на петоъгълен додекаедър; Такъв додекаедър е в основата на газовите хидрати. Следователно няма нищо изненадващо в предположението за съществуването на такива структури във водата, въпреки че вече беше казано, че нито една специфична структура не може да бъде преобладаваща и да съществува дълго време. Затова е странно, че този елемент се приема за основен и че съдържа точно 57 молекули. От топки, например, можете да сглобите същите структури, които се състоят от додекаедри, съседни един на друг и съдържат 200 молекули. Зенин твърди, че процесът на триизмерна полимеризация на водата спира на 57 молекули. Според него не трябва да има по-големи съдружници. Но ако това беше така, шестоъгълните ледени кристали, които съдържат огромен брой молекули, свързани заедно с водородни връзки, не биха могли да се утаят от водна пара. Изобщо не е ясно защо растежът на клъстера Zenin спря на 57 молекули. За да избегне противоречията, Зенин опакова клъстерите в по-сложни образувания - ромбоедри - от почти хиляда молекули, а оригиналните клъстери не образуват водородни връзки помежду си. Защо? С какво молекулите на повърхността им се различават от тези вътре? Според Зенин моделът на хидроксилните групи на повърхността на ромбоедрите осигурява паметта на водата. Следователно водните молекули в тези големи комплекси са твърдо фиксирани, а самите комплекси са твърди вещества. Такава вода няма да тече и нейната точка на топене, която е свързана с молекулното тегло, трябва да бъде много висока.
Какви свойства на водата обяснява моделът на Зенин? Тъй като моделът се основава на тетраедрични структури, той може повече или по-малко да съответства на данните от рентгеновата и неутронната дифракция. Въпреки това е малко вероятно моделът да може да обясни намаляването на плътността по време на топенето; опаковката на додекаедрите е по-малко плътна от леда. Но най-трудно е да се съгласим с модел с динамични свойства - течливост, голяма стойност на коефициента на самодифузия, кратки времена на корелация и диелектрична релаксация, които се измерват в пикосекунди.
Доцент доктор. О.В. Мосин
Препратки:
Г.Г. Маленков. Напредък във физическата химия, 2001 г
S.V.Zenin, B.M. Polanuer, B.V. Тяглов. Експериментално доказателство за наличието на водни фракции. Ж. Хомеопатична медицина и акупунктура. 1997.No.2.P.42-46.
С.В. Зенин, Б.В. Тяглов. Хидрофобен модел на структурата на асоциирани водни молекули. J. Физическа химия, 1994 г. Т. 68. № 4. С. 636-641.
С.В. Зенин Изследване на структурата на водата с помощта на метода на протонния магнитен резонанс. Докл.РАН.1993.Т.332.No3.С.328-329.
S.V.Zenin, B.V.Tyaglov. Природата на хидрофобното взаимодействие. Появата на ориентировъчни полета във водни разтвори. J. Физическа химия, 1994. Т. 68. № 3. С. 500-503.
С.В. Зенин, Б.В. Тяглов, Г. Б. Сергеев, З.А. Шабарова. Изследване на вътрешномолекулни взаимодействия в нуклеотидамиди с помощта на ЯМР. Материали на 2-ра Всесъюзна конф. По динамичен Стереохимия. Одеса.1975.с.53.
С.В. Зенин. Структурираното състояние на водата като основа за контрол на поведението и безопасността на живите системи. Теза. Доктор на биологичните науки. Държавен научен център "Институт по медико-биологични проблеми" (ДНЦ "ИМБП"). Защитена 1999. 05. 27. UDC 577.32:57.089.001.66.207 p.
В И. Слесарев. Доклад за напредъка на изследването
Тамбовски държавен университет на име. Г.Р. Державина
Soros Educational Journal, Том 6, № 9, 2000 г
Вода и лед: знаем ли достатъчно за тях?
Ю. И. ГОЛОВИН
Описани са физичните свойства на водата и леда. Обсъждат се механизмите на различни явления в тези вещества. Въпреки дългия период на изследване и простия химичен състав, водата и ледът – веществата, които са изключително ценни за живота на земята – крият много мистерии поради сложната си динамична протонна и молекулна структура.Даден е кратък преглед на физичните свойства на водата и леда. Разгледани са механизмите на различни явления в тях. Показано е, че въпреки вековната история на изследване, най-простия химичен състав и изключителното значение за живота на Земята, природата на водата и леда е изпълнена с много мистерии поради сложната динамична протонна и молекулна структура.
Въпреки че хората се нуждаят повече от простота,
Все пак комплексът им е по-ясен.
Б.Л. Пащърнак
Може би няма по-разпространено и същевременно по-мистериозно вещество на Земята от водата в течна и твърда фаза. Наистина, достатъчно е да си припомним, че всички живи същества произлизат от вода и се състоят от повече от 50% от нея, че 71% от повърхността на Земята е покрита с вода и лед, а значителна част от северните територии е вечно замръзнала. За да визуализираме общото количество лед на нашата планета, отбелязваме, че ако се стопи, водата в Световния океан ще се повиши с повече от 50 m, което ще доведе до наводняване на гигантски земни площи по цялото земно кълбо. Огромни масиви от лед са открити във Вселената, включително Слънчевата система. Няма нито едно повече или по-малко значимо производство или човешка дейност, в която да не се използва вода. През последните десетилетия бяха открити големи запаси от гориво под формата на твърди ледени хидрати на естествени въглеводороди.
В същото време, след многобройните успехи във физиката и физикохимията на водата през последните години, едва ли може да се твърди, че свойствата на това просто вещество са напълно разбираеми и предвидими. Тази статия предоставя кратък преглед на най-важните физични свойства на водата и леда и нерешени проблеми, свързани главно с физиката на техните нискотемпературни състояния.
Това е сложна молекула
Основите на съвременното разбиране за физическата химия на водата са положени преди около 200 години от Хенри Кавендиш и Антоан Лавоазие, които откриват, че водата не е прост химичен елемент, както са вярвали средновековните алхимици, а съединение на кислород и водород в определено съотношение. Всъщност водородът (хидроген) - който ражда водата - получи името си едва след това откритие и водата придоби своето модерно химично обозначение, което сега е известно на всеки ученик - H 2 O.
И така, молекулата H 2 O е изградена от два водородни атома и един кислороден атом. Както е установено от изследванията на оптичните спектри на водата, в хипотетично състояние на пълна липса на движение (без трептения и въртения), водородните и кислородните йони трябва да заемат позиции във върховете на равнобедрен триъгълник с ъгъл във върха, зает от кислород от 104,5° (фиг. 1, а). В невъзбудено състояние разстоянията между йоните H + и O 2− са 0,96 Å. Благодарение на тази структура водната молекула е дипол, тъй като електронната плътност в областта, където се намира йонът O 2−, е значително по-висока, отколкото в областта на йоните H +, а най-простият модел - моделът на сферите - не е подходящ за описание на свойствата на водата. Можете да си представите водна молекула под формата на топка с две малки издувания в областта, където се намират протоните (фиг. 1, b). Това обаче не помага да се разбере друга характеристика на водата - способността да образува насочени водородни връзки между молекулите, които играят огромна роля в образуването на нейната рохкава, но в същото време много стабилна пространствена структура, която определя повечето от физични свойства както в течно, така и в твърдо състояние.
Ориз. 1.Геометрична диаграма (a), плосък модел (b) и пространствена електронна структура (c) на мономера H 2 O. Два от четирите електрона във външната обвивка на кислородния атом участват в създаването на ковалентни връзки с водородни атоми, а други две образуват силно удължени електронни орбити, равнина, която е перпендикулярна на равнината H–O–H
Нека си припомним, че водородната връзка е връзка между атоми в една молекула или съседни молекули, която се осъществява чрез водороден атом. Той заема междинна позиция между ковалентна и невалентна връзка и се образува, когато водороден атом е разположен между два електроотрицателни атома (O, N, F и др.). Електронът в Н атома е относително слабо свързан с протона, така че максималната електронна плътност се измества към по-електроотрицателен атом и протонът се излага и започва да взаимодейства с друг електроотрицателен атом. В този случай атомите O⋅⋅⋅O, N⋅⋅⋅O и т.н. се приближават. до разстояние, близко до това, което би се установило между тях при отсъствието на атом Н. Водородната връзка определя не само структурата на водата, но също така играе изключително важна роля в живота на биомолекулите: протеини, въглехидрати, нуклеинови киселини и др. .
Очевидно е, че за да се обясни природата на водата е необходимо да се вземе предвид електронната структура на нейните молекули. Както знаете, кислородният атом има четири електрона в горната си обвивка, докато водородът има само един електрон. Образуването на всяка ковалентна O–H връзка включва един електрон от кислородните и водородните атоми. Двата електрона, останали в кислорода, се наричат несподелена двойка, тъй като в изолирана водна молекула те остават свободни, без да участват в образуването на връзки вътре в молекулата H 2 O. Но когато се приближават до други молекули, тези несподелени електрони играят решаваща роля при формирането на молекулярната структура на водата.
Самотните електрони се отблъскват от O–H връзки, така че техните орбити са силно удължени в посока, противоположна на водородните атоми, а орбиталните равнини се завъртат спрямо равнината, образувана от O–H–O връзките. Следователно би било по-правилно да се изобрази водна молекула в триизмерно координатно пространство xyzпод формата на тетраедър, в центъра на който има кислороден атом, а в два върха има водороден атом (фиг. 1, в). Електронната структура на H 2 O молекулите определя условията за тяхното свързване в сложна триизмерна мрежа от водородни връзки както във вода, така и в лед. Всеки от протоните може да образува връзка със самотен електрон на друга молекула. Първата молекула действа като акцептор, а втората действа като донор, образувайки водородна връзка. Тъй като всяка молекула H2O има два протона и два несподелени електрона, тя може да образува четири водородни връзки с други молекули едновременно. По този начин водата е сложна свързана течност с динамичен характер на връзките и описанието на нейните свойства на молекулярно ниво е възможно само с помощта на квантово-механични модели с различна степен на сложност и строгост.
Лед и неговите свойства
От гледна точка на обикновения човек, ледът е повече или по-малко един и същ, независимо къде се образува: в атмосферата като градушка, по ръбовете на покривите като ледени висулки или във водни тела като плочи. От физическа гледна точка има много разновидности на лед, които се различават по своята молекулярна и мезоскопска структура. В лед, съществуващ при нормално налягане, всяка молекула H 2 O е заобиколена от четири други, т.е. координационното число на структурата е четири (така нареченият лед I h). Съответната кристална решетка - шестоъгълна - не е плътно опакована, следователно плътността на обикновения лед (~0,9 g/cm 3) е по-ниска от плътността на водата (~1 g/cm 3), за структурата на която, като Рентгеновите дифракционни изследвания показват, че средното координационно число е ~ 4,4 (срещу 4 за лед I h). Само кислородните атоми заемат фиксирани позиции в структурата на леда. Два водородни атома могат да заемат различни позиции в четирите връзки на молекулата на H 2 O с други съседи. Поради шестоъгълността на решетката кристалите, растящи в свободно състояние (например снежинки), имат шестоъгълна форма.
Шестоъгълната фаза обаче далеч не е единствената форма на съществуване на леда. Точният брой на другите кристални фази - полиморфни форми на лед - все още не е известен. Образуват се при високи налягания и ниски температури (фиг. 2). Някои изследователи смятат наличието на 12 такива фази за точно установено, докато други ги броят до 14. Разбира се, това не е единственото вещество, което има полиморфизъм (спомнете си например графита и диаманта, състоящи се от химически идентични въглеродни атоми ), но броят на различните фази на леда, които продължават да се откриват и до днес, е невероятен. Всичко по-горе се отнася до подреденото разположение на кислородните йони в кристалната решетка на леда. Що се отнася до протоните - водородните йони - както се вижда от неутронната дифракция, има силно разстройство в тяхното подреждане. По този начин кристалният лед е едновременно добре подредена среда (по отношение на кислорода) и в същото време неподредена среда (по отношение на водорода).

Ориз. 2.Фазова диаграма на кристален лед.
Римските цифри показват области на съществуване
образуване на стабилни фази. Лед IV е метастабилен фа-
за, разположен на диаграмата в областта V
Често изглежда, че ледът е ковък и течен. Това е вярно, ако температурата е близка до точката на топене (т.е. t = 0°C при атмосферно налягане) и натоварването се прилага за дълго време. И най-твърдият материал (например метал) при температури, близки до точката на топене, се държи по подобен начин. Пластичната деформация на леда, както и на много други кристални твърди тела, възниква в резултат на зараждането и движението на различни структурни несъвършенства през кристала: празни места, интерстициални атоми, граници на зърната и, най-важното, дислокации. Както беше установено през 30-те години на нашия век, именно наличието на последното предопределя рязкото намаляване на устойчивостта на кристалните твърди тела към пластична деформация (с 10 2 –10 4 пъти спрямо устойчивостта на идеална решетка). Към днешна дата в лед Ih са открити всички видове дислокации, характерни за хексагоналната структура, и са изследвани техните микромеханични и електрически характеристики.
Ефектът от скоростта на деформация върху механичните свойства на монокристалния лед е добре илюстриран на фиг. 3, взето от книгата на Н. Маено. Вижда се, че с увеличаване на скоростта на деформация, механичните напрежения σ, необходими за пластичния поток, бързо нарастват и се появява гигантски зъб на провлачване върху зависимостта на относителната деформация E от σ.

Ориз. 3.(от ). Криви на деформация спрямо напрежението за леден монокристал I h при t = −15°С (плъзгане по базисната равнина, ориентирана под ъгъл 45° спрямо оста на компресия). Числата на кривите показват относителната скорост на деформация ( ∆l– промяна в дължината на пробата лпо време на ∆τ
) в единици от 10 −7 s −1

Ориз. 4.Схема на образуване на дефекти в протонната подсистема на леда: а – двойка йонни дефекти H 3 O + и OH –; b – двойка ориентационни дефекти на Bjerrum D и L
Електрическите свойства на леда са не по-малко забележителни. Големината на проводимостта и нейното експоненциално бързо нарастване с повишаване на температурата рязко разграничават леда от металните проводници и го поставят наравно с полупроводниците. Ледът обикновено е много химически чист, дори ако расте от мръсна вода или разтвор (помислете за чисти, прозрачни парчета лед в мръсна локва). Това се дължи на ниската разтворимост на примесите в структурата на леда. В резултат на това по време на замразяване примесите се изтласкват на фронта на кристализация в течността и не навлизат в структурата на леда. Ето защо прясно падналият сняг винаги е бял, а водата от него е изключително чиста.
Природата разумно е осигурила гигантска станция за пречистване на вода в цялата земна атмосфера. Следователно не може да се разчита на висока проводимост на примеси (както например в легирания силиций) в леда. Но в него няма свободни електрони, както в металите. Едва през 50-те години на 20 век е установено, че носителите на заряд в леда са неподредени протони, т.е. ледът е протонен полупроводник.
Протонното скачане, споменато по-горе, създава два вида дефекти в структурата на леда: йонни и ориентационни (фиг. 4). В първия случай възниква протонен скок по протежение на водородна връзка от една молекула Н 2 О към друга (фиг. 4, а), което води до образуването на двойка йонни дефекти Н 3 О + и ОН -, а в второ - към съседна водородна връзка в една молекула H 2 O (фиг. 4, b), в резултат на което възниква двойка ориентационни дефекти на Bjerrum, наречени L и D-дефекти (от немски leer - празен и doppelt - двоен ). Формално такъв скок може да се разглежда като завъртане на молекулата на Н2О на 120°.
Протичането на постоянен ток поради движението само на йонни или само на ориентационни дефекти е невъзможно. Ако, например, йон H 3 O + премине през някаква част от решетката, тогава следващият подобен йон няма да може да премине през същия път. Въпреки това, ако D-дефект бъде прокаран по този път, подреждането на протоните ще се върне към първоначалното и следователно следващият H 3 O + йон ще може да премине. По подобен начин се държат дефектите OH - и L. Следователно електрическата проводимост на химически чистия лед е ограничена от онези дефекти, които са по-малки на брой, а именно йонните. Диелектричната поляризация, напротив, се дължи на по-многобройни ориентационни дефекти на Bjerrum. Всъщност, когато се приложи външно електрическо поле, и двата процеса протичат паралелно, което позволява на леда да провежда постоянен ток и в същото време да изпитва силна диелектрична поляризация, тоест да проявява както свойствата на полупроводник, така и свойствата на изолатор. През последните години продължават опитите за откриване на фероелектричните и пиезоелектричните свойства на чистия лед при ниски температури както в обема, така и на междуфазните граници. Все още няма пълна увереност в тяхното съществуване, въпреки че са открити няколко псевдо-пиезоелектрични ефекта, свързани с наличието на дислокации и други структурни дефекти.
Физика на повърхността и кристализация на лед
Във връзка с развитието на полупроводниковата технология, микроминиатюризацията на елементната база и прехода към планарни технологии, интересът към повърхностната физика се увеличи значително през последното десетилетие. Разработени са много сложни техники за изследване на близки до повърхността състояния в твърди тела, които се оказаха полезни при изследването на метали, полупроводници и диелектрици. Въпреки това, структурата и свойствата на ледената повърхност в близост до пара или течност остават до голяма степен неясни. Една от най-интригуващите хипотези, изложена от М. Фарадей, е съществуването на повърхността на леда на квазитечен слой с дебелина от десетки до стотици ангстрьома, дори при температура доста под точката на топене. Основата за това са не само спекулативни конструкции и теории за структурата на близки до повърхността слоеве на силно поляризирани H 2 O молекули, но и фини определяния (с помощта на ядрено-магнитен резонанс) на фазовото състояние на ледената повърхност, както и нейната повърхностна проводимост и нейната зависимост от температурата. Въпреки това, в повечето практически важни случаи, повърхностните свойства на снега и леда най-вероятно се определят от наличието на макроскопичен филм от вода, а не от квази-течен слой.
Топенето на повърхностните слоеве лед под въздействието на слънчева светлина, по-топла атмосфера или плъзгащо се върху нея твърдо тяло (кънки, ски, пътеки за шейни) е от решаващо значение за постигане на нисък коефициент на триене. Ниското триене на плъзгане не е резултат от намаляване на температурата на топене под въздействието на повишено налягане, както често се смята, а следствие от отделянето на топлина от триене. Изчисленията показват, че ефектът от налягането, дори при плъзгане на остро заточена кънка върху лед, при което се развива налягане от около 1 MPa, води до намаляване на температурата на топене само с ~0,1 ° C, което не може да има значителен ефект върху количеството триене.
Установена традиция в описването на свойствата на водата и леда е твърдението и обсъждането на много аномални свойства, които отличават това вещество сред неговите хомолози (H 2 S, H 2 Se, H 2 Te). Може би най-важното е много високата (сред простите вещества) специфична топлина на топене (кристализация) и топлинен капацитет, тоест ледът трудно се топи, а водата трудно замръзва. В резултат на това климатът на нашата планета като цяло е доста мек, но при липса на вода (например в пустините на гореща Африка) контрастът между дневните и нощните температури е много по-висок, отколкото на брега на океана в същото време географска ширина. Жизненоважно за биосферата е свойството да увеличава обема си по време на кристализация, а не да намалява, както правят по-голямата част от известните вещества. В резултат на това ледът плува във водата, вместо да потъва, и значително забавя замръзването на водните басейни в студено време, защитавайки всички живи същества, които намират убежище в него за зимата. Това се улеснява и от немонотонната промяна на плътността на водата, когато температурата падне до 0°C – едно от най-известните аномални свойства на водата, открито преди повече от 300 години. Максималната плътност се постига при t = 4°C и това предотвратява потъването на приповърхностните слоеве вода, охладени до температура под 4°C, на дъното. Конвективното смесване на течността е блокирано, което значително забавя по-нататъшното охлаждане. Други аномалии на водата са известни от доста дълго време: срязващ вискозитет при 20°C, специфична топлина при 40°C, изотермична свиваемост при 46°C, скорост на звука при 60°C. Вискозитетът на водата намалява с увеличаване на налягането и не се увеличава, както при други течности. Ясно е, че аномалните свойства на водата се дължат на структурните особености на нейната молекула и спецификата на междумолекулните взаимодействия. По отношение на последното все още не е постигната пълна яснота. Свойствата, описани по-горе, се отнасят за водата, леда и границата между тях, съществуващи в условията на термодинамично равновесие. Проблеми от съвсем различно ниво на сложност възникват, когато се опитваме да опишем динамиката на фазовия преход вода-лед, особено при условия, далеч от термодинамичното равновесие.
Термодинамичната причина за всеки фазов преход е разликата в химичните потенциали на частиците от едната и другата страна на интерфейса ∆µ = µ 1 −µ 2. Химическият потенциал µ е функция на състоянието, която определя промените в термодинамичните потенциали, когато броят N на частиците в системата се промени, т.е. µ = G/N, където G = H − TS е термодинамичният потенциал на Гибс, H е енталпията, S е ентропия, T е температура. Разликата в термодинамичните потенциали е движещата сила на макроскопичен процес (точно както разликата в електрическите потенциали в краищата на проводника е причината за електрически ток). При µ1 = µ2 и двете фази могат да съществуват едновременно в равновесие толкова дълго, колкото желаете. При нормално налягане химическият потенциал на водата е равен на химическия потенциал на леда при t = 0°C. При t< 0°С более низким химическим потенциалом обладает лед, но это еще не означает, что при любом, самом маленьком переохлаждении начнется кристаллизация. Опыт показывает, что тщательно очищенный от примесей, обезгаженный, деионизированный расплав может быть переохлажден относительно точки равновесия фаз на десятки кельвин (а для некоторых веществ и на сотни). Анализ показывает, что причина заключается в отсутствии зародышей новой фазы (центров кристаллизации, конденсации, парообразования и т.д.).
Ембрионите също могат да се образуват хомогенно, тоест от самата среда, която е в метастабилно състояние, но за това трябва да бъдат изпълнени определени условия. Нека започнем да разглеждаме ситуацията, като вземем предвид факта, че всеки интерфейс между кристала и стопилката (или пара, разтвор) въвежда допълнителна енергия Sα, където S е граничната площ, α е повърхностната енергия. В допълнение, N молекулите, които образуват зародишния кристал, имат енергия, по-ниска от тази в течността с N∆µ. В резултат на това общата промяна на енергията в системата при появата на ядро ∆U = −N∆µ + Sα ще се окаже немонотонно зависима от N. Действително, за сферична форма на ядрото
![]()
където A = (36πV 2) 1/3 V е обемът на една молекула в кристала. От предходното следва, че ∆U достига максимум ∆Uc = - N c ∆µ + AN c 2/3 α, когато ядрото съдържа N c = (2Aα/3∆µ) 3 молекули.
По този начин, с последователното добавяне на молекули към ядрото, системата трябва първо да се изкачи до върха на потенциалния хълм с височина ∆U c, в зависимост от преохлаждането, след което ще настъпи по-нататъшен растеж на N в кристала с намаляване на енергия, тоест по-лесно. Изглежда, че колкото по-ниска е температурата на течността, т.е. колкото по-силно е преохлаждането, толкова по-бърза кристализация трябва да настъпи. Това всъщност е случаят, когато хипотермията не е твърде голяма. Въпреки това, когато t намалява, вискозитетът на течността също нараства експоненциално, което затруднява движението на молекулите. В резултат на това при високи степени на преохлаждане процесът на кристализация може да се проточи в продължение на много години (какъвто е случаят с чаши от различен произход).
Числените оценки показват, че за вода при нормални степени на преохлаждане в естествени условия (∆t = 1–10°C), ембрионът трябва да се състои от няколко десетки молекули, което е значително по-голямо от координационното число в течната фаза (∼4.4 ). По този начин системата изисква голям брой опити за флуктуация, за да се изкачи до върха на енергийния хълм. В не много добре пречистена вода силното преохлаждане се предотвратява от наличието на вече съществуващи центрове на кристализация, които могат да бъдат частици примеси, прахови частици, неравности по стените на съда и др. Впоследствие кинетиката на растеж на кристалите зависи от условията на топлообмена в близост до междуфазната граница, както и върху морфологията на последната на атомно ниво.молекулярно ниво.
Силно преохладената вода има две характерни температури t h = −36°C и t g = −140°C. Добре пречистената и дегазирана вода в температурния диапазон 0°С > t > t h може да остане в състояние на преохладена течност за дълго време. При t g< t < t h происходит гомогенное зарождение кристалликов льда, и вода не может находиться в переохлажденном состоянии при любой степени очистки. В условиях достаточно быстрого охлаждения при t < tg подвижность молекул воды настолько падает (а вязкость растет), что она образует стеклообразное твердое тело с аморфной структурой, свойственной жидкостям. При этом в области невысоких давлений образуется аморфная фаза низкой плотности, а в области повышенных – аморфная фаза высокой плотности, то есть вода демонстрирует полиаморфизм. При изменениях давления или температуры одна аморфная фаза скачком переходит в другую с неожиданно большим изменением плотности (>20%).
Съществуват няколко гледни точки относно природата на водния полиаморфизъм. Така, според , това поведение на силно преохладена вода може да се обясни, ако приемем, че в потенциалния профил на взаимодействието на две молекули H2O има повече от един минимум,

Ориз. 5(от ). Хипотетични потенциални профили: a – с един енергиен минимум (например потенциалът на Ленард-Джоунс U(r) = A/r 6 − B/r 12) и b – с два енергийни минимума, които съответстват на две стабилни конфигурации на a клъстер от две взаимодействащи молекули вода (1 и 2) с различни разстояния между условните центрове на молекулите r H и r L; първият от тях съответства на фаза с по-висока плътност, вторият – с по-ниска
и две (фиг. 5). Тогава аморфната фаза с висока плътност ще съответства на средното разстояние rH, а фазата с ниска плътност – rL. Компютърното моделиране потвърждава тази гледна точка, но все още няма надеждни експериментални доказателства за тази хипотеза, нито има строга теория, потвърждаваща валидността на използването на потенциала на двойния кладенец за описание на такива необичайни свойства на свръхохладената вода.
Поведението на преохладената вода е от голям интерес по различни причини. По-специално, той определя климатичните условия, възможността и начина на корабоплаване във високи географски ширини, което е от значение за нашата страна. По време на процеса на динамична кристализация на повърхността настъпват много интересни и все още слабо разбрани явления, например преразпределение на примеси, разделяне и последващо отпускане на електрически заряди, придружено от електромагнитно излъчване в широка честотна лента и т.н. И накрая, кристализацията в силно преохладена течност е отлична, лесно възпроизводима многократно моделна ситуация на поведение на система, която е далеч от термодинамичното равновесие и е способна, в резултат на развитието на нестабилности, на образуване на дендрити от различни порядъци и размери ( типични представители са снежинките и ледените шарки по прозорците), удобни за създаване и моделиране на поведението на фрактали.
На пръв поглед процесите на топене на лед изглеждат по-лесни за анализ от процесите на кристализация. Те обаче оставят и много въпроси. Например, широко разпространено е мнението, че стопената вода за известно време има свойства, различни от свойствата на обикновената вода, поне по отношение на биологични обекти: растения, животни, хора. Вероятно тези характеристики могат да се дължат на висока химическа чистота (поради отбелязания нисък коефициент на улавяне на примеси по време на кристализация на лед), разлики в съдържанието на разтворени газове и йони, както и съхранение на структурата на леда в многомолекулни клъстери на течността фаза. Авторът обаче не разполага с надеждна информация за това, получена чрез съвременни физични методи.
Не по-малко труден е анализът на механизмите на влияние на външните физически полета, по-специално магнитните полета, върху процесите и свойствата на водата, леда и фазовите преходи. Целият ни живот протича в условията на постоянно действие на магнитното поле на Земята и неговите слаби колебания. Магнитобиологията и методите за магнитно лечение в медицината се развиват в продължение на много векове. И накрая, агрегатите се произвеждат масово и се използват широко за магнетизиране на вода, използвана за напояване в селското стопанство (с цел повишаване на производителността), захранване на парни котли (за намаляване на скоростта на образуване на котлен камък в тях) и др. Все още обаче няма задоволително физическо описание на механизмите на действие на магнитното поле в тези и други подобни случаи.
Заключение
Водата, ледът и техните взаимни фазови трансформации все още са изпълнени с много мистерии. Разрешаването им е не само много интересен физически проблем, но е и изключително важен за живота на Земята, тъй като е пряко свързан с човешкото здраве и благополучие. Може би те предоставят един от най-ярките примери за ролята на електронната и молекулярната структура във формирането на физичните свойства на най-простия и добре известен химичен състав на веществото.
Литература:
1. Богородски В.В., Гаврило В.П. Лед. Л.: Гидрометеоиздат, 1980. 384 с.
2. Маено Н. Науката за леда. М.: Мир, 1988. 231 с.
3. Хобс П.В. Физика на леда. Оксфорд: Univ. Прес, 1974. 864 с.
4. Зацепина Г.Н. Физични свойства и структура на водата. М.: Издателство на Московския държавен университет, 1998. 184 с.
5. Мишима О., Стенли Е. Връзката между течна, преохладена и стъклена вода // Nature. 1998. Том. 396. стр. 329–335.
6. Золотухин И.В. Фрактали във физиката на твърдото тяло // Образователен вестник на Сорос. 1998. № 7. С. 108–113. Рецензент на статията B.A. Струков
Юрий Иванович Головин, доктор на физико-математическите науки, професор, ръководител. Катедра по теоретична и експериментална физика, Тамбовски държавен университет. Г.Р. Державин, заслужил деятел на науката на Руската федерация. Област на научни интереси е електронната структура на дефектите в твърдите тела и макроскопичните свойства, причинени от тях. Автор и съавтор на повече от 200 научни труда, включително монографии и 40 изобретения.
Лед- минерални с хим формула H 2 O, представлява вода в кристално състояние.
Химичен състав на леда: H - 11,2%, O - 88,8%. Понякога съдържа газообразни и твърди механични примеси.
В природата ледът е представен главно от една от няколко кристални модификации, стабилни в температурния диапазон от 0 до 80 ° C, с точка на топене 0 ° C. Има 10 известни кристални модификации на лед и аморфен лед. Най-изследван е ледът от 1-ва модификация - единствената модификация, срещана в природата. Ледът се среща в природата под формата на самия лед (континентален, плаващ, подземен и т.н.), както и под формата на сняг, скреж и др.
Вижте също:
СТРУКТУРА
Кристалната структура на леда е подобна на структурата: всяка молекула H 2 0 е заобиколена от четирите най-близки до нея молекули, разположени на равни разстояния от нея, равни на 2,76Α и разположени във върховете на правилен тетраедър. Поради ниското координационно число структурата на леда е ажурна, което се отразява на неговата плътност (0,917). Ледът има шестоъгълна пространствена решетка и се образува от замръзване на вода при 0°C и атмосферно налягане. Решетката на всички кристални модификации на лед има тетраедрична структура. Параметри на ледена елементарна клетка (при t 0°C): a=0.45446 nm, c=0.73670 nm (c е двойното разстояние между съседни основни равнини). Когато температурата падне, те се променят много малко. Молекулите H 2 0 в решетката на леда са свързани една с друга чрез водородни връзки. Подвижността на водородните атоми в решетката на леда е много по-висока от подвижността на кислородните атоми, поради което молекулите сменят своите съседи. При наличието на значителни вибрационни и ротационни движения на молекулите в ледената решетка се появяват транслационни скокове на молекулите от мястото на тяхната пространствена връзка, нарушавайки по-нататъшния ред и образувайки дислокации. Това обяснява проявата на специфични реологични свойства в леда, които характеризират връзката между необратими деформации (течение) на леда и предизвикалите ги напрежения (пластичност, вискозитет, граница на провлачване, пълзене и др.). Поради тези обстоятелства ледниците текат подобно на силно вискозни течности и по този начин естественият лед участва активно във водния цикъл на Земята. Ледените кристали са сравнително големи по размер (напречен размер от части от милиметър до няколко десетки сантиметра). Те се характеризират с анизотропия на коефициента на вискозитет, чиято стойност може да варира с няколко порядъка. Кристалите са способни да се преориентират под въздействието на натоварвания, което влияе върху тяхната метаморфизация и дебита на ледниците.
ИМОТИ

Ледът е безцветен. В големи клъстери придобива синкав оттенък. Стъклен блясък. Прозрачен. Няма деколте. Твърдост 1.5. Чуплив. Оптично положителен, индекс на пречупване много нисък (n = 1,310, nm = 1,309). В природата са известни 14 модификации на леда. Вярно, всичко освен познатия ни лед, който кристализира в хексагоналната система и се обозначава като лед I, се образува при екзотични условия - при много ниски температури (около -110150 0C) и високо налягане, когато ъглите на водородните връзки във водата се променят. промяна на молекулата и се образуват системи, различни от хексагоналните. Такива условия наподобяват тези в космоса и не се срещат на Земята. Например при температури под –110 °C водните пари се утаяват върху метална плоча под формата на октаедри и кубчета с размери няколко нанометра - това е така нареченият кубичен лед. Ако температурата е малко над –110 °C и концентрацията на пари е много ниска, върху плочата се образува слой от изключително плътен аморфен лед.
МОРФОЛОГИЯ

Ледът е много разпространен минерал в природата. В земната кора има няколко вида лед: речен, езерен, морски, почвен, фирнов и ледников. По-често образува агрегатни клъстери от финокристални зърна. Известни са също кристални ледени образувания, които възникват чрез сублимация, тоест директно от парното състояние. В тези случаи ледът изглежда като скелетни кристали (снежинки) и агрегати от скелетен и дендритен растеж (пещерен лед, скреж, скреж и шарки върху стъкло). Срещат се големи добре шлифовани кристали, но много рядко. Н. Н. Стулов описва ледени кристали в североизточната част на Русия, открити на дълбочина 55-60 м от повърхността, имащи изометричен и колонен вид, а дължината на най-големия кристал е 60 см, а диаметърът на основата му е 15 см. От прости форми върху ледени кристали са идентифицирани само лицата на шестоъгълната призма (1120), шестоъгълната бипирамида (1121) и пинакоида (0001).
Ледените сталактити, разговорно наричани „ледени висулки“, са познати на всеки. При температурни разлики от около 0° през есенно-зимния сезон те се развиват навсякъде по повърхността на Земята с бавното замръзване (кристализация) на течаща и капеща вода. Те също са често срещани в ледените пещери.
Ледените брегове са ивици ледена покривка, изградена от лед, който кристализира на границата вода-въздух по ръбовете на резервоарите и граничи с ръбовете на локви, бреговете на реки, езера, езера, резервоари и др. като останалата част от водното пространство не замръзва. Когато те се срастнат напълно, върху повърхността на резервоара се образува непрекъсната ледена покривка.
Ледът също така образува успоредни стълбовидни агрегати под формата на влакнести вени в порести почви и ледени антолити на тяхната повърхност.
ПРОИЗХОД

Ледът се образува главно във водни басейни, когато температурата на въздуха спадне. В същото време на повърхността на водата се появява ледена каша, съставена от ледени игли. Отдолу върху него растат дълги ледени кристали, чиито оси на симетрия от шести ред са разположени перпендикулярно на повърхността на кората. Връзките между ледените кристали при различни условия на образуване са показани на фиг. Ледът е често срещан навсякъде, където има влага и където температурата пада под 0° C. В някои райони земният лед се размразява само до малка дълбочина, под която започва вечната замръзналост. Това са така наречените вечно замръзнали зони; В районите на разпространение на вечна замръзналост в горните слоеве на земната кора се намира така нареченият подземен лед, сред който се разграничават модерен и изкопаем подземен лед. Най-малко 10% от общата земна площ е покрита с ледници; монолитната ледена скала, която ги съставя, се нарича ледников лед. Ледниковият лед се образува предимно от натрупването на сняг в резултат на неговото уплътняване и трансформация. Ледената покривка покрива около 75% от Гренландия и почти цялата Антарктика; най-голямата дебелина на ледниците (4330 m) се намира близо до станцията Byrd (Антарктика). В централната част на Гренландия дебелината на леда достига 3200 m.
Ледените залежи са добре известни. В райони със студени, дълги зими и къси лета, както и във високопланински райони се образуват ледени пещери със сталактити и сталагмити, сред които най-интересни са Кунгурская в Пермския район на Урал, както и Добшинската пещера в гр. Словакия.
Когато морската вода замръзне, се образува морски лед. Характерните свойства на морския лед са солеността и порьозността, които определят диапазона на неговата плътност от 0,85 до 0,94 g/cm 3 . Поради такава ниска плътност, ледените късове се издигат над повърхността на водата с 1/7-1/10 от тяхната дебелина. Морският лед започва да се топи при температури над -2,3°C; той е по-еластичен и по-трудно се разбива на парчета от сладководния лед.
ПРИЛОЖЕНИЕ

В края на 80-те години лабораторията Argonne разработи технология за производство на ледена суспензия, която може да тече свободно през тръби с различни диаметри, без да се събира в ледени натрупвания, да се слепва или да запушва охладителните системи. Солената водна суспензия се състоеше от множество много малки ледени кристали с кръгла форма. Благодарение на това се поддържа подвижността на водата и в същото време, от гледна точка на топлотехниката, тя представлява лед, който е 5-7 пъти по-ефективен от обикновената студена вода в охладителните системи на сградите. Освен това такива смеси са перспективни за медицината. Експериментите върху животни показват, че микрокристалите от ледената смес преминават перфектно в сравнително малки кръвоносни съдове и не увреждат клетките. „Ледена кръв“ удължава времето, през което жертвата може да бъде спасена. Да речем, в случай на сърдечен арест това време се удължава, според консервативни оценки, от 10-15 до 30-45 минути.
Използването на лед като конструктивен материал е широко разпространено в полярните райони за изграждане на жилища - иглута. Ледът е част от материала Pikerit, предложен от Д. Пайк, от който беше предложено да се направи най-големият самолетоносач в света.
Лед - H 2 O
КЛАСИФИКАЦИЯ
| Strunz (8-мо издание) | 4/A.01-10 |
| Nickel-Strunz (10-то издание) | 4.AA.05 |
| Дана (8-мо издание) | 4.1.2.1 |
| Хей, CIM Ref. | 7.1.1 |